Superioridad de la inmunidad tópica en proteger y combatir virus respiratorios
El peso de la evidencia
A pesar de la puesta en práctica de vacunación masiva contra el SARS-CoV-2, no ha sido posible correlacionar el efecto que las vacunas inducen en humanos con el fin de alcanzar una protección COVID-19, que asegure un retorno a la normalidad en un futuro razonablemente cercano. La creciente evidencia de que no todos los sujetos expuestos al contagio desarrollen la enfermedad o que otros, si se contagian cursan asintomáticos, ha volcado la atención sobre los mecanismos del tipo de inmunidad que ejerce su acción por otros medios a los humorales y pone en tela de duda, el énfasis casi universal que se centró sobre el desarrollo de anticuerpos neutralizantes, como única y supuestamente infalible medida, para controlar la pandemia. A la mano de lo anterior, se ha constatado que un 10-33% (Oran and Topol 2021; Cervia et al. 2021), de los pacientes con enfermedad leve, no desarrollan anticuerpos durante su convalecencia, pero con clara presencia de células T reactivas, SARS-CoV-2 o coronavirus endémico (HCoV-229E, -OC43) específica, sensibles a reto con péptidos de la espícula y la nucleocápside, con perfil polifuncional tipo (IFNλ, TNFα, y IL-2) y las cuales permanecen detectables hasta 162 días luego de haber dado positivo el paciente a la prueba RT-PCR y de seguir seronegativo (Steiner, Schwarz and Corman 2021). Inclusive células T específicas al SARS del 2003 y con reactividad cruzada al SARS-CoV-2, presentes bien 17 años después en contraste con los anticuerpos que tienden a desvanecer (Le Bert et al. 2020; Tang, Xin and others 2011; Yang et al. 2006). Recientemente, en el primer reto experimental en humanos sanos con virus agreste, 47% de los pacientes no se infectaron en absoluto (Chiu, C. et al. 2022). Estos datos, señalan que las medidas tomadas para combatir la pandemia, han resultado mal orientadas y que están plagadas de lagunas crasas, por omisión de conocimiento existente sobre los otros mecanismos que ofrecen protección real, contra los virus que atacan el sistema respiratorio. Ya desde inicios de la pandemia, en mayo del 2020, la pre-existencia de células T imprimadas por coronavirus comunes (huCoV) y con reacción cruzada al SARS-CoV-2, habían sido identificadas en cohortes de sujetos sanos y no expuestos al SARS-CoV-2 previamente (Mateus et al. 2020)(Grifoni et al. 2020)(Nelde et al. 2021)(Le Bert et al. 2020)(Quiros-Fernandez et al. 2021). Como también que la reactividad de las células T en caso de exposición o no exposición al SARS2, no está únicamente distribuida a epítopes de la espícula y que abarca a los tipos, M (membrana), N (nucleocápside) y una variedad de ORFs (sistema replicativo) (Grifoni et al. 2020), reactividad similar en cierto grado en los no expuestos, a la protección que COVID19 induce en el cuerpo humano, figura n°1. 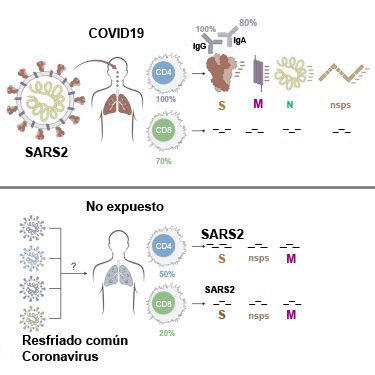 Durante el avance de la pandemia, estudios sucesivos a los citados se dieron a la tarea de comparar pre-pandemia con pandemia y fue posible dilucidar la diferencia entre sujetos no expuestos y el perfil inmunológico que los enfermos por COVID-19 desarrollan y el de los asintomáticos, o de quienes desarrollan enfermedad muy breve y leve, pudiéndose catalogar esta última como abortiva. Conspícuo entre todos, resultó ser el estudio de Steiner et al., el cual detectó que un 10% de los pacientes convalecientes de enfermedad muy breve y leve, mostraron serología negativa, o en otros términos: ausencia de conversión. Eso arrojó dudas, sobre la inducción y la persistencia, de células T en estos individuos. No obstante presentaban un claro perfil de inmunidad celular con presencia de células T reactivas, específicas y contra coronavirus endémicos (HuCoV-229E, -OC43), sensibles a proteína de la espícula S, charca de péptidos de la nucleocápside N y con un perfil citocínico polifuncional (IFNγ, TNFα, y IL-2); perfil que resultó muy similar entre convalescientes sero + y -, a los controles no expuestos (Steiner, Schwarz and Corman 2021)(Sekine et al. 2020)(Kundu et al. 2022). Un estudio similar pero en una población de trabajadores del cuidado de la salud, fuertemente expuestos a contagio por contacto cercano con pacientes, sustentó sólidamente la evidencia de que los trabajadores presentaron infecciones seronegativas de tipo abortivo, con presencia de células T reactivas a proteínas no estructurales, pero con preferencia a las de aparato replicativo RTC (tipo ORF1ab) y en especial de tipo polimerasa. Estas células pudieron ser estimuladas y expandidas antes que el grupo de sujetos entrara en contacto con SARS2 (Swadling et al. 2022). También se documentó, que células CD8+ T SARS2 específicas, reconocían igualmente a epítopes de HuCOV del aparato replicativo NSP12, los cuales son altamente conservados genéticamente y que toleran escasa variación mutacional. El estudio analizó únicamente la inmunidad periférica, pero estableció sólidamente la participación periférica en el aclaramiento viral para enfermedad abortiva, y la cual puede llevarse a cabo, sin seroconversión. Es decir, que el aclaramiento ocurre a cargo del aparato innato (sin anticuerpos) y con restricción del ciclo de vida viral, la producción de sgRNA y la puesta en marcha de la mediación-RNA-polimerasa para la replicación viral. El ciclo de vida viral es truncado, durante el primer paso de la producción de proteínas estructurales, lo cual evita la maduración de viriones (Yamada et al. 2021). A pesar de la compartimentación que existe del sistema inmune tópico, se ha comprobado la presencia de una relación de este con el humoral. De manera que, la respuesta humoral en individuos que han desarrollado inmunidad de mucosas hacia los retos respiratorios, sorprendentemente determina también en el sistema humoral un sesgo hacia la predominancia de respuesta humoral tipo IgA o ausencia de seroconversión, como arriba se ilustra. También se ha observado que para ese perfil, la respuesta inmune celular es de poca monta o está ausente. En un estudio ex-vivo de células sanguíneas en cuidadores de salud de primer nivel en Suecia (n=156), se observó que al estimularlas con péptidos de la espícula S y de la nucleocápside N de SARS-CoV-2, que las células provenientes de individuos que se contagiaron pero no se enfermaron, o si se enfermaron y no murieron de COVID-10, montaron un perfil tipo IgA con anticuerpos parcialmente neutralizantes o ausencia de seroconversión, con escasa inmunidad de tipo celular. Las células de individuos que se enfermaron y los que murieron de Covid-19, tuvieron respuesta de tipo IgG con anticuerpos altamente neutralizantes y respuesta específica de células T, e incluso de tipo citotóxico CD4+ T, que expresaban CD25, CD38, CD69, CD194, CD279, CTLA-4, y granzima B. Destaca en el primer grupo que algunos estos pacientes eran portadores de cuadros de alergia respiratoria y otros era fumadores. Los que no enfermaron, fueron un 10% de la población estudiada (Hennings, V. et al. 2022).
Durante el avance de la pandemia, estudios sucesivos a los citados se dieron a la tarea de comparar pre-pandemia con pandemia y fue posible dilucidar la diferencia entre sujetos no expuestos y el perfil inmunológico que los enfermos por COVID-19 desarrollan y el de los asintomáticos, o de quienes desarrollan enfermedad muy breve y leve, pudiéndose catalogar esta última como abortiva. Conspícuo entre todos, resultó ser el estudio de Steiner et al., el cual detectó que un 10% de los pacientes convalecientes de enfermedad muy breve y leve, mostraron serología negativa, o en otros términos: ausencia de conversión. Eso arrojó dudas, sobre la inducción y la persistencia, de células T en estos individuos. No obstante presentaban un claro perfil de inmunidad celular con presencia de células T reactivas, específicas y contra coronavirus endémicos (HuCoV-229E, -OC43), sensibles a proteína de la espícula S, charca de péptidos de la nucleocápside N y con un perfil citocínico polifuncional (IFNγ, TNFα, y IL-2); perfil que resultó muy similar entre convalescientes sero + y -, a los controles no expuestos (Steiner, Schwarz and Corman 2021)(Sekine et al. 2020)(Kundu et al. 2022). Un estudio similar pero en una población de trabajadores del cuidado de la salud, fuertemente expuestos a contagio por contacto cercano con pacientes, sustentó sólidamente la evidencia de que los trabajadores presentaron infecciones seronegativas de tipo abortivo, con presencia de células T reactivas a proteínas no estructurales, pero con preferencia a las de aparato replicativo RTC (tipo ORF1ab) y en especial de tipo polimerasa. Estas células pudieron ser estimuladas y expandidas antes que el grupo de sujetos entrara en contacto con SARS2 (Swadling et al. 2022). También se documentó, que células CD8+ T SARS2 específicas, reconocían igualmente a epítopes de HuCOV del aparato replicativo NSP12, los cuales son altamente conservados genéticamente y que toleran escasa variación mutacional. El estudio analizó únicamente la inmunidad periférica, pero estableció sólidamente la participación periférica en el aclaramiento viral para enfermedad abortiva, y la cual puede llevarse a cabo, sin seroconversión. Es decir, que el aclaramiento ocurre a cargo del aparato innato (sin anticuerpos) y con restricción del ciclo de vida viral, la producción de sgRNA y la puesta en marcha de la mediación-RNA-polimerasa para la replicación viral. El ciclo de vida viral es truncado, durante el primer paso de la producción de proteínas estructurales, lo cual evita la maduración de viriones (Yamada et al. 2021). A pesar de la compartimentación que existe del sistema inmune tópico, se ha comprobado la presencia de una relación de este con el humoral. De manera que, la respuesta humoral en individuos que han desarrollado inmunidad de mucosas hacia los retos respiratorios, sorprendentemente determina también en el sistema humoral un sesgo hacia la predominancia de respuesta humoral tipo IgA o ausencia de seroconversión, como arriba se ilustra. También se ha observado que para ese perfil, la respuesta inmune celular es de poca monta o está ausente. En un estudio ex-vivo de células sanguíneas en cuidadores de salud de primer nivel en Suecia (n=156), se observó que al estimularlas con péptidos de la espícula S y de la nucleocápside N de SARS-CoV-2, que las células provenientes de individuos que se contagiaron pero no se enfermaron, o si se enfermaron y no murieron de COVID-10, montaron un perfil tipo IgA con anticuerpos parcialmente neutralizantes o ausencia de seroconversión, con escasa inmunidad de tipo celular. Las células de individuos que se enfermaron y los que murieron de Covid-19, tuvieron respuesta de tipo IgG con anticuerpos altamente neutralizantes y respuesta específica de células T, e incluso de tipo citotóxico CD4+ T, que expresaban CD25, CD38, CD69, CD194, CD279, CTLA-4, y granzima B. Destaca en el primer grupo que algunos estos pacientes eran portadores de cuadros de alergia respiratoria y otros era fumadores. Los que no enfermaron, fueron un 10% de la población estudiada (Hennings, V. et al. 2022).
La inmunidad tópica al rescate
No fue hasta que se condujeran estudios para valorar la inmunidad en la mucosa nasal, a la par de la humoral, que este hallazgo comenzara a revestirse de gran significancia. Los signos de la presencia de una fuerte inmunidad de mucosa en estos individuos, le dieron verdadero sentido a la no-conversión, como se explicará a continuación. Un estudio de muestras en sujetos adultos asintomáticos y sintomáticos, por pares tomados en suero y cavidad nasal, fueron analizadas por contenido de citocinas/quimiocinas, perfil comprensivo de anticuerpos con amplio repertorio de epítopes, quinética de anticuerpos sensibles a la espícula, el receptor de enlace espicular a SARS2 y la neutralización a variantes preocupantes SARS2, demostró en primer lugar, que existe independencia de la respuesta de los anticuerpos en las mucosas y la humoral (compartimentación), en especial, con la respuesta a etítopes por parte de las IgM/IgG/IgA y de la proprocionalidad de las inmuniglobulinas en cada ámbito. La afinidad hacia las proteínas de prefusión de la espícula, fue más relevante en los asintimáticos que los sintomáticos. La respuesta citocínica resultó más intensa en las muestras nasales que en las del suero, en general, pero más intensa en asintomáticos que sintomáticos y hubo mayor tendencia a reconocer las cepas de variantes preocupantes, por los asintomáticos en comparación a los sintomáticos. Con la tecnología Biblioteca de Despliegue de Fagos en Fragmentos de Genoma (GFPDL) es posible examinar la avidez de las inmuniglobulinas por epítopes, y los fagos que se adhieren a la IgA de las muestras nasales, fue 100 mayor que en las del suero (Ravichandran et al. 2021; Cervia et al. 2021). Igualmente ha sido demostrado que existe compartimentación inmunológica, en varios ámbitos de la mucosa orofaríngea (Moutsopoulos and Konkel 2018)(Silva-Sanchez and Randall 2020)(Wu et al. 2014)(Byrd et al. 2020)(Bankvall et al. 2018)(Brandtzaeg 2013) . 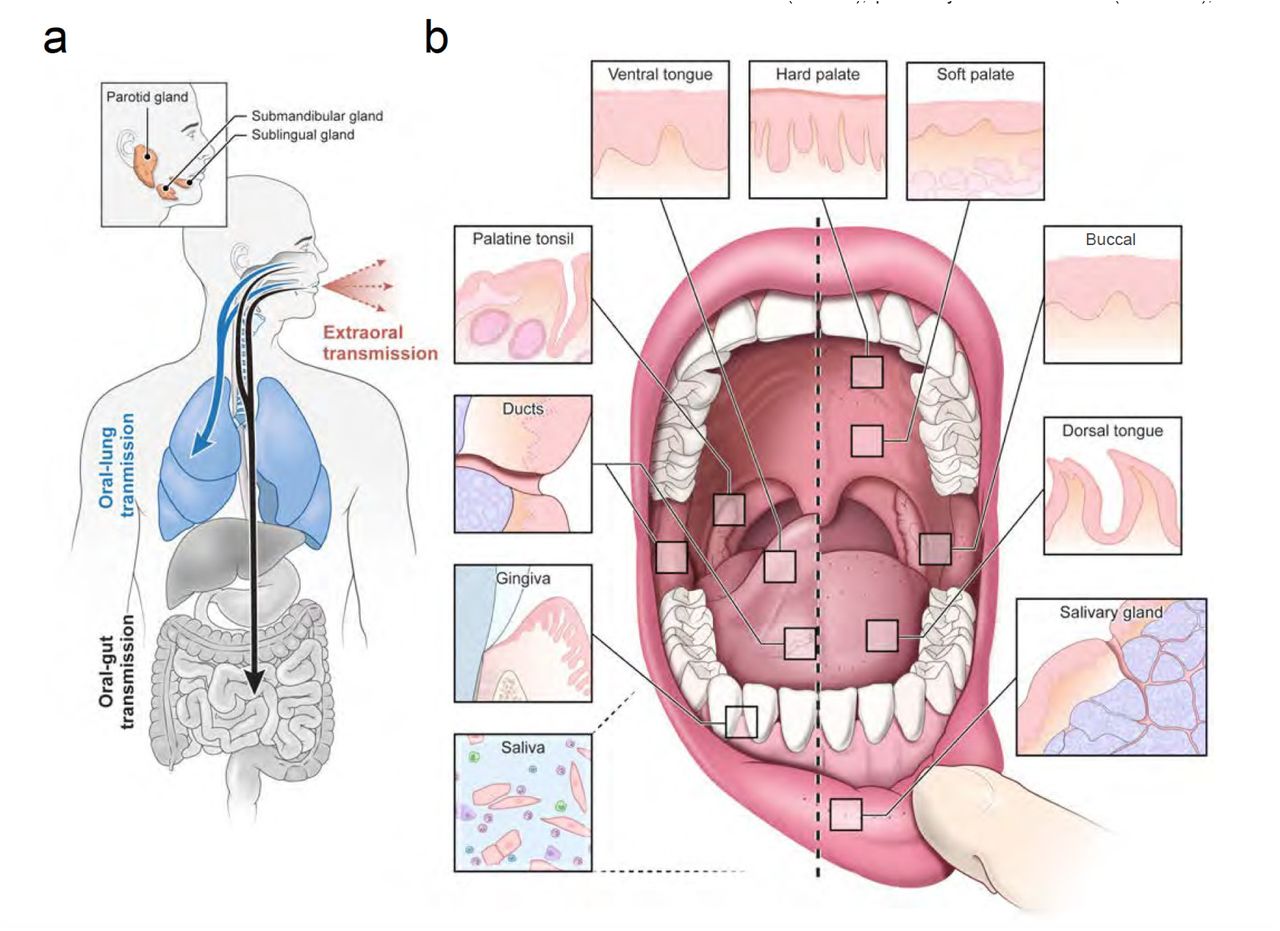 Fig n°2 Tomado de (Byrd et al. 2020) La compartimentación que existe en el aparato respiratorio alto, debe de ser valorada respecto al peso que tiene en combatir el ingreso de la enfermedad en el humano. Al ser inmunidad tejido/específica, tópicamente funge como un microambiente, donde precisa que sus condiciones específicas sean reguladas y sean mantenidas estables . Si no se toma en cuenta el aspecto topológico, no puede existir un enfoque congruente en controlar las afecciones virales respiratorias. Al contrario, un enfoque dirigido a mantener condiciones de microambiente estables en la naso y orofaringe, hará posible ejercer un mejor control contra las infecciones y podrá correlacionarse mejor como parte del aparato inmunológico, con la inmunidad sistémica. El análisis cuantitativo de Igs presentes en todas las secreciones mucosas, incluyendo la evaluación de los caudales totales de estas secreciones, muestra que la producción de SIgA es, por mucho, la más abundante de todos los isotipos de Ig, equivalente a una producción estimada de 5-10 gramos diarios en un humano adulto. Esta abundancia se refleja también en la distribución de las células inmunitarias por todo el cuerpo: aproximadamente dos tercios de todas las células linfoides (T, B, innatas y su descendencia) se encuentran en los tejidos mucosos, y las células accesorias, incluidas las células dendríticas y los fagocitos, siguen un patrón similar. A partir de estos simples hechos, se puede inferir que la protección de las mucosas es la función cotidiana principal de todo el sistema inmunitario que opera «24/7/52». Esto no debería sorprender, dado que la gran mayoría de las enfermedades infecciosas se adquieren a través de las superficies mucosas expuestas al entorno externo, y que los tractos oral, gastrointestinal, respiratorio y genital (femenino) están naturalmente colonizados por una microbiota extensa que debe mantenerse en coexistencia con el huésped, pero inhibida a invadir el hospedero. Esto se logra mediante el sistema inmunitario mucoso común. La migración de las células a los sitios efectores mucosos se orquesta mediante la expresión de direccioninas endoteliales vasculares y la producción de ligandos quimiocinas en sitios efectores mucosos, así como integrinas y receptores de quimiocinas correspondientes expresados en células B y T inducidas en sitios inductivos mucosos. La diferenciación terminal de células B en células plasmáticas secretoras de pIgA ocurre en estos sitios efectores con ayuda de células T y citocinas producidas localmente. La SIgA se forma mediante el transporte transepitelial inducido por el receptor pIgR de la pIgA localmente sintetizada y transportada hacia el lumen, siendo el componente extracelular del pIgR el elemento secretor de la SIgA (Russell, M. W., & Mestecky, J. (2022)).
Fig n°2 Tomado de (Byrd et al. 2020) La compartimentación que existe en el aparato respiratorio alto, debe de ser valorada respecto al peso que tiene en combatir el ingreso de la enfermedad en el humano. Al ser inmunidad tejido/específica, tópicamente funge como un microambiente, donde precisa que sus condiciones específicas sean reguladas y sean mantenidas estables . Si no se toma en cuenta el aspecto topológico, no puede existir un enfoque congruente en controlar las afecciones virales respiratorias. Al contrario, un enfoque dirigido a mantener condiciones de microambiente estables en la naso y orofaringe, hará posible ejercer un mejor control contra las infecciones y podrá correlacionarse mejor como parte del aparato inmunológico, con la inmunidad sistémica. El análisis cuantitativo de Igs presentes en todas las secreciones mucosas, incluyendo la evaluación de los caudales totales de estas secreciones, muestra que la producción de SIgA es, por mucho, la más abundante de todos los isotipos de Ig, equivalente a una producción estimada de 5-10 gramos diarios en un humano adulto. Esta abundancia se refleja también en la distribución de las células inmunitarias por todo el cuerpo: aproximadamente dos tercios de todas las células linfoides (T, B, innatas y su descendencia) se encuentran en los tejidos mucosos, y las células accesorias, incluidas las células dendríticas y los fagocitos, siguen un patrón similar. A partir de estos simples hechos, se puede inferir que la protección de las mucosas es la función cotidiana principal de todo el sistema inmunitario que opera «24/7/52». Esto no debería sorprender, dado que la gran mayoría de las enfermedades infecciosas se adquieren a través de las superficies mucosas expuestas al entorno externo, y que los tractos oral, gastrointestinal, respiratorio y genital (femenino) están naturalmente colonizados por una microbiota extensa que debe mantenerse en coexistencia con el huésped, pero inhibida a invadir el hospedero. Esto se logra mediante el sistema inmunitario mucoso común. La migración de las células a los sitios efectores mucosos se orquesta mediante la expresión de direccioninas endoteliales vasculares y la producción de ligandos quimiocinas en sitios efectores mucosos, así como integrinas y receptores de quimiocinas correspondientes expresados en células B y T inducidas en sitios inductivos mucosos. La diferenciación terminal de células B en células plasmáticas secretoras de pIgA ocurre en estos sitios efectores con ayuda de células T y citocinas producidas localmente. La SIgA se forma mediante el transporte transepitelial inducido por el receptor pIgR de la pIgA localmente sintetizada y transportada hacia el lumen, siendo el componente extracelular del pIgR el elemento secretor de la SIgA (Russell, M. W., & Mestecky, J. (2022)).
Experimentalmente, la superioridad de la inmunidad tópica queda fuera de duda. Un modelo de vacunación intranasal en ratones, basado en un vector adenoviral tripartito que expresa tres antígenos SARS-CoV-2 de proteína de la espícula 1, proteínas totales de la nucleocápside y polimerasa trunca, ha demostrado ser netamente superior en proteger al grupo de animales que recibió la vacuna intranasal, en comparación con la administrada por vía intramuscular. La intranasal con dosis única fue superior inclusive en inducir inmunidad humoral e incomparable en la inmunidad celular y las respuestas de las células T de las vías respiratorias altas, en la respuesta multifuncional de las células T residentes, en la memoria entrenada de los macrófagos de las vías respiratorias altas, y en conferir en conjunto, una potente protección al contagio, dependiente de células B y T, sea al virus agreste que a las variantes de preocupación. En caso de contagio, la inmunidad que confiere la vía intranasal, disminuye drásticamente, sea la carga viral que el derramamiento de virus a nivel nasal (Afkhami, S. et al. 2022). La propiedad de la inmunidad cruzada parece una protección intrínseca de la inmunidad tópica, debido a los abundantes epítopes de la proteína de la espícula a lo largo de su superficie, reconocidos por las células T en general. Al contrario, la dependencia de la inmunidad humoral frente al RBD es específica y pobre para reconocer las variantes que pueden surgir respecto del epítope primario (Mateus, J. et al. 2020).
El microambiente nasofaríngeo
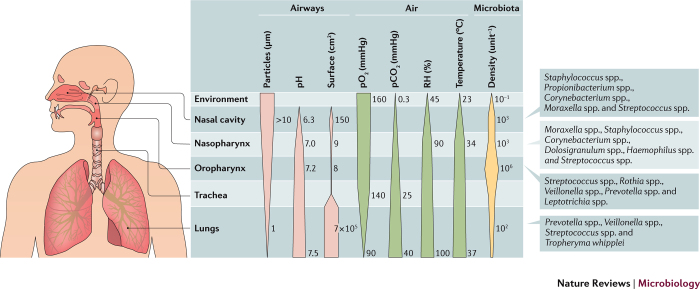 Tomado de Man, Nat Rev Microbiol. 2017; 15(5): 259–270. La figura n°3 es ilustrativa del microambiente e introduce la variable de la microbiota que se relaciona con el hospedero, en la mucosa nasofaríngea. En esta se mezclan gradientes fisiológicos con gradientes microbianos, a lo largo de ambas mucosas naso y orofaríngeas, la traquea y los pulmones. El pH aumenta gradualmente a lo largo del tracto respiratorio, mientras que la mayor parte del aumento en humedad relativa (RH) y de temperatura ocurre en la cavidad nasal. Las presiones parciales de oxígeno (pO2) y de dióxido de carbono (pCO2), muestra gradientes opuestos los cuales los determina el ambiente del aire inhalado y las condiciones tópicas de intercambio gaseoso en la superficie de la mucosa pulmonar. La inhalación resulta en la deposición de partículas provenientes del aire ambiente de usualmente un diámetro >10 μm y que se depositan en el tracto respiratorio alto. Pero partículas con diámetro <1μm, se depositan en la muosa pulmonar y que típicamente miden >0.4μm. Tales parámetros mixtos, determinan el nicho específico y el tipo de colonización tópica por las comunidades microbianas. La densidad se mide en bacterias por cm3 de aire habitacional. Se determinan, en la cavidad nasal, por número de bacterias extraídas mediante tampón nasal y en la cavidad oral y la mucosa pulmonar, por las bacterias extraídas mediante lavado bucal y bronquealveolar respectivamente (BAL). Los parámetros fisiológicos determinan las condiciones selectivas para el crecimiento bacteriano de cada nicho y conforman las comunidades microbianas que colonizan el aparato respiratorio y entre ambas, moldean el microambiente de cada mucosa. La participación de la microbiota es notoria en dicha determinación y se asocia a la producción de citocinas IL-33, IFN-γ, IFN-α/β y IFN-λ3. La infección con SARS-CoV-2, trastorna la homeostasis simbiótica/mutualista y los niveles de dichas citocinas merman, sea directa que indirectamente. La diversidad de la microbiota disminuye con la enfermedad COVID19 establecida. La microbiota ha sido directamente asociada con el mantenimiento de la producción constitutiva de interferon tipo I,II, y III y en modular la resistencia a infecciones virales en ratones. Existen correlaciones positivas en controlar virus con la colonización de Prevotella y Streptococcus y correlaciones negativas con Corynebacterium y Dolosigranulum. Se ha vinculado la presencia del género Staphylococcus con altos niveles en plasma de IL-6. Transporte de virus por patobiontes ha sido postulado como mecanismo facilitador de enfermedades respiratorias altas en 40% de sujetos sanos, que presentan «disbosis» tópica y debido a la colonización por Streptococcus pneumonia, Haemophilus influenzae no-tipificable, y Moraxella catarrhalis (Chapman et al. 2020). Este tipo de desbalance, puede rendir a estos individuos, mayormente suceptibles a la morbilidad por SARS2 (Man, de Steenhuijsen Piters and Bogaert 2017).
Tomado de Man, Nat Rev Microbiol. 2017; 15(5): 259–270. La figura n°3 es ilustrativa del microambiente e introduce la variable de la microbiota que se relaciona con el hospedero, en la mucosa nasofaríngea. En esta se mezclan gradientes fisiológicos con gradientes microbianos, a lo largo de ambas mucosas naso y orofaríngeas, la traquea y los pulmones. El pH aumenta gradualmente a lo largo del tracto respiratorio, mientras que la mayor parte del aumento en humedad relativa (RH) y de temperatura ocurre en la cavidad nasal. Las presiones parciales de oxígeno (pO2) y de dióxido de carbono (pCO2), muestra gradientes opuestos los cuales los determina el ambiente del aire inhalado y las condiciones tópicas de intercambio gaseoso en la superficie de la mucosa pulmonar. La inhalación resulta en la deposición de partículas provenientes del aire ambiente de usualmente un diámetro >10 μm y que se depositan en el tracto respiratorio alto. Pero partículas con diámetro <1μm, se depositan en la muosa pulmonar y que típicamente miden >0.4μm. Tales parámetros mixtos, determinan el nicho específico y el tipo de colonización tópica por las comunidades microbianas. La densidad se mide en bacterias por cm3 de aire habitacional. Se determinan, en la cavidad nasal, por número de bacterias extraídas mediante tampón nasal y en la cavidad oral y la mucosa pulmonar, por las bacterias extraídas mediante lavado bucal y bronquealveolar respectivamente (BAL). Los parámetros fisiológicos determinan las condiciones selectivas para el crecimiento bacteriano de cada nicho y conforman las comunidades microbianas que colonizan el aparato respiratorio y entre ambas, moldean el microambiente de cada mucosa. La participación de la microbiota es notoria en dicha determinación y se asocia a la producción de citocinas IL-33, IFN-γ, IFN-α/β y IFN-λ3. La infección con SARS-CoV-2, trastorna la homeostasis simbiótica/mutualista y los niveles de dichas citocinas merman, sea directa que indirectamente. La diversidad de la microbiota disminuye con la enfermedad COVID19 establecida. La microbiota ha sido directamente asociada con el mantenimiento de la producción constitutiva de interferon tipo I,II, y III y en modular la resistencia a infecciones virales en ratones. Existen correlaciones positivas en controlar virus con la colonización de Prevotella y Streptococcus y correlaciones negativas con Corynebacterium y Dolosigranulum. Se ha vinculado la presencia del género Staphylococcus con altos niveles en plasma de IL-6. Transporte de virus por patobiontes ha sido postulado como mecanismo facilitador de enfermedades respiratorias altas en 40% de sujetos sanos, que presentan «disbosis» tópica y debido a la colonización por Streptococcus pneumonia, Haemophilus influenzae no-tipificable, y Moraxella catarrhalis (Chapman et al. 2020). Este tipo de desbalance, puede rendir a estos individuos, mayormente suceptibles a la morbilidad por SARS2 (Man, de Steenhuijsen Piters and Bogaert 2017).
Mecanismo de acción
Además de lo arriba expuesto, para que un virus pueda establecerse en el epitelio de la mucosa naso y orofaríngea, se encuentra con un estrato doble glicoproteíco de muco (gel y sol/periciliar) y la membrana basal. Las mucinas contribuyen a la inmunidad innata mediante su interacción con defensinas y colectinas antimicrobianas (Gallo et al. 2021). Su interacción con la IgA dimérica tópica, es de gran importancia en vista de que su actividad neutralizante contra del SARS-CoV-2, ha sido cuantificada en promedio, 15 veces geométricamente mayor a la de la IgA monomérica sistémica (Wang et al. 2021). Las características de los microambientes de la mucosa naso y orofaringes, abren ventanas de oportunidad muy valiosas en controlar los retos respiratorios altos en su fase preliminar. Medidas a controlar el microambiente y en reforzar los estratos mucínicos con glicopolímeros mucoadherentes en húmedo de alto peso molecular y capaces de atrapar los virus mediante atracción electroestática, llenan el cometido de prevenir la infección mediante el mecanismo de inmuno-exclusión, utilizando un dispositivo de rociado en la cavidad nasal y de cepillado con sucesiva aplicación tópica, en la cavidad oral. Es la aplicación práctica de principios de glicobiología mediante un gel mucoadherente, el cual además de estar formulado para controlar los parámetros básicos del microambiente de pH, potencial redox y bioenergético, su contenido de polisacáridos de alto peso molecular y sus características hidrofílicas y polianiónicas, le confiere cualidades únicas. Se trata de la carragenina iota y de su estructura dimérica y cadenas lineares largas, que en conjunto despliega densas cargas negativas y que contiene heparán sulfato, igualmente cargado negativamente. Los virus tienen carga eléctrica positiva y cuando buscan los receptores celulares ACE para adherirse al epitelio, se orientan hacia el heparán sulfato con carga negativa que las células epiteliales contienen en su superficie. Pero en este caso, la carragenina iota se interpone en el camino. Las cargas negativas en la superficie del dominio de receptor-obligatorio (RBD) en las proteínas de la espícula, interacciona con el heparán sulfato del polianión sulfatado, lo que excluye por competencia que el virus se adhiera los receptores ACE de la superficie celular epitelial y en vez, los virus quedan atrapados en la densa matriz del polímero polianiónico y se evita la infección (Nie et al. 2022). Las mucinas por su alto contenido de ácido siálico y sulfatos, con carga negativa igualmente, actúan en conjunto con la carragenina exógena y la acción mucociliar, para alejar los virus y conducirlos a destrucción en el ambiente gástrico (Fröba 2021). 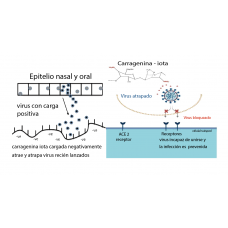 Fig. n° 4 Modificado de (Eccles 2020) La naturaleza no-farmacológica y no-toxológica de las moléculas polianiónicas sulfatadas, como carragenina iota, junto con la ausencia de absorción y bio-transformación, las convierten en antivirales biológicamente inertes para aplicación tópica. La concentración inhibidora media máxima (IC50) luego de infección con variantes de preocupación (VOCs) se excluye la eventualidad de interacciones covalentes específica con una cepa en particular, convirtiendo al encierre de los viriones en polianiones sulfatados, una valiosa herramienta de amplio espectro, para neutralizar cualquier variante viral que evolucione a tiempo futuro (Fröba 2021).
Fig. n° 4 Modificado de (Eccles 2020) La naturaleza no-farmacológica y no-toxológica de las moléculas polianiónicas sulfatadas, como carragenina iota, junto con la ausencia de absorción y bio-transformación, las convierten en antivirales biológicamente inertes para aplicación tópica. La concentración inhibidora media máxima (IC50) luego de infección con variantes de preocupación (VOCs) se excluye la eventualidad de interacciones covalentes específica con una cepa en particular, convirtiendo al encierre de los viriones en polianiones sulfatados, una valiosa herramienta de amplio espectro, para neutralizar cualquier variante viral que evolucione a tiempo futuro (Fröba 2021). 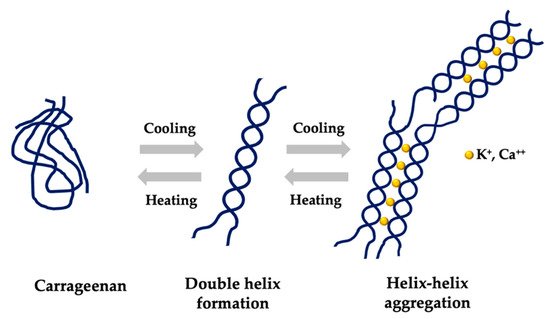 Fig n°5 La figura representa el mecanismo de gelación de la carragenina kapa y iota en dos etapas: a temperatura ambiente las cadenas están enroscadas, pero con el calentamiento se entrelazan y al enfriar, forman una doble espiral en contacto e interacción con K+y Ca++.(Pacheco-Quito, Ruiz-Caro y Veiga 2020) Si se combinan con goma gelan, se obtiene un aumento de viscosidad complejo que se prolonga en el tiempo y se llegan a formar interacciones entre el polímero y la mucina y que resultan en una resistencia creciente gradual de la tendencia del gel a fluir. Es un aumento que triplica la viscosidad y lo vuelve más mucoadherente. Una razón para explicar el efecto se debe a que la goma gelan posee muchísimos más hidroxilos que la carragenina iota, y por tanto le agrega al gel mayor capacidad de ligarse a las mucinas, aparte de otros enlaces secundarios y de carácter estérico existentes. Lo anterior permite una prolongada residencia y de retención del gel en la cavidad oral y nasal, aumentando su capacidad de atrapar y encerrar virus.
Fig n°5 La figura representa el mecanismo de gelación de la carragenina kapa y iota en dos etapas: a temperatura ambiente las cadenas están enroscadas, pero con el calentamiento se entrelazan y al enfriar, forman una doble espiral en contacto e interacción con K+y Ca++.(Pacheco-Quito, Ruiz-Caro y Veiga 2020) Si se combinan con goma gelan, se obtiene un aumento de viscosidad complejo que se prolonga en el tiempo y se llegan a formar interacciones entre el polímero y la mucina y que resultan en una resistencia creciente gradual de la tendencia del gel a fluir. Es un aumento que triplica la viscosidad y lo vuelve más mucoadherente. Una razón para explicar el efecto se debe a que la goma gelan posee muchísimos más hidroxilos que la carragenina iota, y por tanto le agrega al gel mayor capacidad de ligarse a las mucinas, aparte de otros enlaces secundarios y de carácter estérico existentes. Lo anterior permite una prolongada residencia y de retención del gel en la cavidad oral y nasal, aumentando su capacidad de atrapar y encerrar virus.
¿Incitación adaptativa?
Esta vía ofrece además la posibilidad de inducir inmunidad directamente mediante secreción de linfopoietina tímica del estroma del epitelio de la mucosa (TSLP). factor clave en la diferenciación de las células dendríticas CD11b+ y que favorece la producción de citocinas inductoras de IgA. tipo APRIL, BAFF, IL-8 y TGF-β. De estas, destaca la IL-8 y de la cual principalmente la estimulación de TSLP depende y que se induzca la producción de IgA en microambientes mucosos. Lo anterior encuentra sustento en el hallazgo de TSLP exógena que promueve in vitro la producción de IgA en cultivo de células DC-B y que responde a la estimulación de IL-6 que resulta en un aumento ulterior de IgA (Joo et al. 2017). La TSLP producida por las células dendríticas de las mucosas, sugiere una activación directa del sistema inmune adaptativo, tanto de tipo autócrino en el propio sitio de inducción y luego además que asiste a producir respuestas antígeno específicas de la IgA, de tipo humoral. Sub-lineajes de células dendríticas, tales como CCR5+CCR6+ DCs nasales or TLR5+ DCs en la lámina propia de la mucosa instestinal, se han identifcado involucradas en inducción de producción de IgA luego de inmunización o de estimulación bacteriana nasal, además que otros factores producidos adicionalmente por las DCs o células B, pueden también estimular la producción de IgA mediada por la TSLP (Uematsu et al. 2008; Fukuyama et al. 2013). Estudios in vivo han dilucidado mecanismos específicos de la TSLP, mediante la estimulación en ratones con la proteina A de superficie de neumococo, para la diferenciación de células dentríticas CD1b+ en la lámina propia mucosa nasal, incitando las defensas tópicas con producción de citocinas favorecedoras de la producción de IgA, tales como APRIL, BAFF, IL-6, y TGF-b y de cómo la presencia en el microambiente de IL-6, aumenta la defensa antiviral (Joo et al. 2016). Polisacáridos como los glucanos, dextrano, inulina (fructanos), sean originados de plantas que de microrganismos, han demostrado que logran estimular sea la inmunidad por anticuerpos, que la inmunidad celular (Petrovsky, N. and Cooper, P. D. 2011). Digno de mención al respecto, es la constatación de que sujetos asintomáticos con COVID-19 muestran un aumento de las DCs plasmacitoides en la sangre (Severa et al. 2021). Las células dendríticas plasmacitoides, son mediadoras de inmunidad viral cuando detectan la presencia de ácidos nucléicos virales y responden mediante la secreción de IFN I (Gilliet, Cao and Liu 2008). Por el contrario, se encuentran marcadamente disminuidas o están ausentes del todo en sujetos con COVID grave (Zingaropoli et al. 2021).
Los productos de degradación lisosomal más recientemente han sido reconocidos por ser presentados mediante el complejo mayor de histocompatibilidad (MHC) clase II a los linfocitos CD4+ T y son estas células auxiliares precisamente las que orquestan la respuesta inmune específica (Tallóczy, Jiang, & Virgin 2002). La autofagia dirige los patógenos hacia los autofagosomas para luego ser fusionados con los lisosomas (Gutierrez, Master, & Singh 2004)(Nakagawa, Amano, & Mizushima 2004) (Birmingham, Smith, & Bakowski 2006). De manera que los epítopes de los patógenos como los antígenos intracelulares pueden hacer contacto con las moléculas MHC clase II (Nimmerjahn, Milosevic, & Behrends 2003) (Dengjel et al. 2005) (Paludan, Schmid, & Landthaler 2005) (Zhou, Li, & Lin 2005). No es de sorprenderse por ello que las vías autofágicas tengan capacidad inmunogénica. Además de su papel en la inmunidad innata, la autofagia alerta al sistema inmune adaptativo sobre patógenos detectados y presentados por las células dendríticas para la degradación lisosomal y para activar, en añadidura, la inmunogénesis adaptativa.
Otras fuentes describen una presentación prolongada de antígenos mediante un proceso autofágico autóctono. Funciona con revestimiento del fagosoma con la proteína LC3 y por el cual el complejo MCH-II/antígeno queda marcado para la presentación prolongada. De manera que sale a la luz que la autofagia posee sus mecanismos propios de presentación (Romao, Gasser, & Becker 2013).
Ingrediente complementario
El xilitol es un poliol conocido como un sustituto de la sucrosa desde 1960 y también extensivamente usado en el cuidado bucal, con poder demostrado de prevenir caries en vista de su efecto antibacteriano. Igualmente ha sido usado en otorrinolaringología como un espray nasal para el tratamiento de rinosinusitis y prevención de otitis media en niños (Sakallioğlu, Güvenç and Cingi 2014; Lin et al. 2017). Existe evidencia in vitro y en modelos de animales de acción antiviral en virus respiratorio sinticial (Xu et al. 2016). Recientemente en estudios in vitro sobre una combinación de carragenina iota y xilitol para inhibir el SARS-CoV-2 en cultivos de células Vero, las muestras de controles con xilitol únicamente, mostraron poseer poder antiviral contra este virus (Xu et al. 2016).
Glicobiología en acción
El aborde glicobiológico de BioAcyl Corp en la preparación de las intervenciones naso y orofaríngeas en prevenir y tratar retos respiratorios altos, es único. Además de lo arriba expuesto, es necesario considerar que las interacciones que ocurren entre el medioambiente, la microbiota que convive con los humanos y el aparato inmunológico, son muy complejas y que constan de diferentes modalidades: sea protectiva (contra patógenos) que admisiva (soporta los mutualistas), la cual hace posible nuestra convivencia en la bioesfera. Tales interrelaciones, llevan al frente ciertos monosacáridos comol-fucosea(Fuc), mannosa (Man), galactosa (Gal) y cietros ácidos siálicos y que forman los patrones mediante los cuales se comunican procariotas con eucariotas. Los patrones que miman el ambiente del hospedero por parte de los comensales o alimentos, hacen posible la tolerancia y los que difieren, contrariamente desencadenan los procesos inmunológicos de protección (Kononova et al. 2021). La primera línea de contacto de tales interrelaciones, se ubica en las mucosas. Por tal razón, no extraña que formulaciones con base en glicanos, puedan tener el alcance de estimular respuestas immunológicas, tanto innatas como adaptativas. Siguiendo tal línea de pensamiento, Rhinactil y Periactil Complete, ofrecen una gama de posibilidades de protección de retos respiratorios altos de ampio espectro y que es altamente eficaz, sin que exista el riesgo de experimentar efectos secundarios. Destaca la mucoadherencia que se obtiene con ambos productos y que se acrecienta durante el lapso de la aplicación, el cual se ha comprobado se extiende por >12hrs y especialmente en la mucosa nasofaríngea, donde la tendencia a escurrir de sustancias extrañas y aclarar es notoria, por la acción mucociliar. Aparte de los argumentos que soportan la protección que confiere el Rhinactil, está el hecho singular de que es un excelente dilatador de las fosas nasales, por sí mismo.
Referencias
Afkhami, S. et al. (2022) “Respiratory mucosal delivery of next-generation COVID-19 vaccine provides robust protection against both ancestral and variant strains of SARS-CoV-2, Cell. doi: 10.1016/j.cell.2022.02.005.
Bankvall, M., Jontell, M., Wold, A. & others (2018) Tissue-specific Differences in Immune Cell Subsets Located in the Naso-oropharyngeal-associated Lymphoid Tissues. Scand. J. Immunol. 87 15—27.
Brandtzaeg, P. (2013) Secretory immunity with special reference to the oral cavity. Journal of Oral Microbiology, 5 20401.
Byrd, K. M., Huang, N., Perez, P., Kato, T., Mikami, Y., Okuda, K., Gilmore, R. C., Conde, C. D., Gasmi, B., Stein, S., Beach, M., Pelayo, E., Maldonado-Ortiz, J., LaFont, B., Padilla, R., Murrah, V., Maile, R., Lovell, W., Wallet, S., Bowman, N. M., Meinig, S. L., Wolfgang, M. C., Choudhury, S. N., Novotny, M., Aevermann, B. D., Scheuermann, R., Cannon, G., Anderson, C., Marchesan, J., Bush, M., Freire, M., Kimple, A., Herr, D. L., Rabin, J., Grazioli, A., French, B. N., Pranzatelli, T. J. F., Chiorini, J. A., Kleiner, D. E., Pittaluga, S., Hewitt, S., Burbelo, P. D., Chertow, D., , , Frank, K. M., Lee, J., Boucher, R. B. C. C., Teichmann, S. A. & Warner, B. M. (2020) Integrated Single-Cell Atlases Reveal an Oral SARS-CoV-2 Infection and Transmission Axis. medRxiv, 2020.10.26.20219089.
Russell, M. W., & Mestecky, J. (2022). Mucosal immunity: The missing link in comprehending SARS-CoV-2 infection and transmission. Frontiers in immunology, Volume 13 – 2022
Cervia, C., Nilsson, J., Zurbuchen, Y. & others (2021) Systemic and mucosal antibody responses specific to SARS-CoV-2 during mild versus severe COVID-19. J. Allergy Clin. Immunol. 147 545—557.e9.
Chapman, T. J., Morris, M. C., Xu, L. & others (2020) Nasopharyngeal colonization with pathobionts is associated with susceptibility to respiratory illnesses in young children. PloS one, 15 e0243942.
Dengjel, J., Schoor, O., Fischer, R., Reich, M., Kraus, M., & Müller, M., et al. (2005). Autophagy promotes MHC class II presentation of peptides from intracellular source proteins. Proceedings of the National Academy of Sciences of the United States of America, 102(22), 7922–7927.
Eccles, R. (2020) Iota-Carrageenan as an Antiviral Treatment for the Common Cold. The Open Virology Journal, 14.
Fröba, M. (2021) Iota-Carrageenan Inhibits Replication of SARS-CoV-2 and the Respective Variants of Concern Alpha, Beta, Gamma and Delta. International Journal of Molecular Sciences, 22.
Fukuyama, Y., Tokuhara, D., Sekine, S. & others (2013) Potential Roles of CCR5+ CCR6+ Dendritic Cells Induced by Nasal Ovalbumin plus Flt3 Ligand Expressing Adenovirus for Mucosal IgA Responses. PloS one, 8 e60453.
Gallo, O., Locatello, L. G., Mazzoni, A. & others (2021) The central role of the nasal microenvironment in the transmission, modulation, and clinical progression of SARS-CoV-2 infection – Mucosal Immunology. Mucosal Immunol. 14 305—316.
Gilliet, M., Cao, W. & Liu, Y.-J. (2008) Plasmacytoid dendritic cells: sensing nucleic acids in viral infection and autoimmune diseases. Nature Reviews Immunology, 8 594—606.
Grifoni, A., Weiskopf, D., Ramirez, S. I., Mateus, J., Dan, J. M., Moderbacher, C. R., Rawlings, S. A., Sutherland, A., Premkumar, L., Jadi, R. S., Marrama, D., de Silva, A. M., Frazier, A., Carlin, A. F., Greenbaum, J. A., Peters, B., Krammer, F., Smith, D. M., Crotty, S. & Sette, A. (2020) Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals. Cell, 181 1489—1501.e15.
Gutierrez, M. G., Master, S. S., & Singh, S. B. (2004). Autophagy is a defense mechanism inhibiting bcg and mycobacterium tuberculosis survival in infected macrophages. Cell, 119(6), 753–766.
Joo, M. S., Kim, W. D., Lee, K. Y., Kim, J. H., Koo, J. H. & Kim, S. G. (2016) AMPK Facilitates Nuclear Accumulation of Nrf2 by Phosphorylating at Serine 550. Molecular and Cellular Biology, 36 1931.
Joo, S., Fukuyama, Y., Park, E. J. & others (2017) Critical role of TSLP-responsive mucosal dendritic cells in the induction of nasal antigen-specific IgA response – Mucosal Immunology. Mucosal Immunol. 10 901—911.
Kononova, S., Litvinova, E., Vakhitov, T. & others (2021) Acceptive Immunity: The Role of Fucosylated Glycans in Human HosttextendashMicrobiome Interactions. Int. J. Mol. Sci. 22.
Kundu, R., Narean, J. S., Wang, L. & others (2022) Cross-reactive memory T cells associate with protection against SARS-CoV-2 infection in COVID-19 contacts – Nature Communications. Nat. Commun. 13 1—8.
Le Bert, N., Tan, A. T., Kunasegaran, K. & others (2020) SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS, and uninfected controls – Nature. Nature, 584 457—462.
Lin, L., Tang, X., Wei, J., Dai, F. & Sun, G. (2017) Xylitol nasal irrigation in the treatment of chronic rhinosinusitis. American Journal of Otolaryngology, 38 383—389.
Man, W. H., de Steenhuijsen Piters, W. A. A. & Bogaert, D. (2017) The microbiota of the respiratory tract: gatekeeper to respiratory health. Nat. Rev. Microbiol. 15 259.
Mateus, J., Grifoni, A., Tarke, A., Sidney, J., Ramirez, S. I., Dan, J. M., Burger, Z. C., Rawlings, S. A., Smith, D. M., Phillips, E., Mallal, S., Lammers, M., Rubiro, P., Quiambao, L., Sutherland, A., Yu, E. D., da Silva Antunes, R., Greenbaum, J., Frazier, A., Markmann, A. J., Premkumar, L., de Silva, A., Peters, B., Crotty, S., Sette, A. & Weiskopf, D. (2020) Selective and cross-reactive SARS-CoV-2 T cell epitopes in unexposed humans. Science,
Moutsopoulos, N. M. & Konkel, J. E. (2018) Tissue-Specific Immunity at the Oral Mucosal Barrier. Trends Immunol. 39 276—287.
Nakagawa, I., Amano, A., & Mizushima, N. (2004). Autophagy defends cells against invading group a streptococcus. Science, 306(5698), 1037–1040.
Nelde, A., Bilich, T., Heitmann, J. S. & others (2021) SARS-CoV-2-derived peptides define heterologous and COVID-19-induced T cell recognition – Nature Immunology. Nat. Immunol. 22 74—85.
Nie, C., Sahoo, A. K., Herrmann, A. & others (2022) Charge Matters: Mutations in Omicron variant favor Binding to Cells. Circ. Res. n/a.
Nimmerjahn, F., Milosevic, S., & Behrends, U. (2003). Major histocompatibility complex class ii-restricted presentation of a cytosolic antigen by autophagy. European Journal of Immunology, 33(5), 1250–1259.
Oran, D. P. & Topol, E. J. (2021) The Proportion of SARS-CoV-2 Infections That Are Asymptomatic. Ann. Intern. Med.
Pacheco-Quito, E.-M., Ruiz-Caro, R. & Veiga, M.-D. (2020) Carrageenan: Drug Delivery Systems and Other Biomedical Applications. Marine drugs, 18 583.
Paludan, C., Schmid, D., & Landthaler, M. (2005). Endogenous mhc class ii processing of a viral nuclear antigen after autophagy. Science, 307(5709), 593–596.
Quiros-Fernandez, I., Poorebrahim, M., Fakhr, E. & others (2021) Immunogenic T cell epitopes of SARS-CoV-2 are recognized by circulating memory and naive CD8 T cells of unexposed individuals. EBioMedicine, 72.
Ravichandran, S., Grubbs, G., Tang, J. & others (2021) Systemic and mucosal immune profiling in asymptomatic and symptomatic SARS-CoV-2textendashinfected individuals reveal unlinked immune signatures. Sci. Adv.
Romao, S., Gasser, N., & Becker, A. C. (2013). Autophagy proteins stabilize pathogen-containing phagosomes for prolonged MHC II antigen processing. Journal of Cell Biology, 203(5), 757–766.
Sakallioğlu, Ö., Güvenç, A. I. & Cingi, C. (2014) Xylitol and its usage in ENT practice. The Journal of Laryngology & Otology, 128 580—585.
Sekine, T., Perez-Potti, A., Rivera-Ballesteros, O. & others (2020) Robust T Cell Immunity in Convalescent Individuals with Asymptomatic or Mild COVID-19. Cell, 183 158.
Severa, M., Diotti, R. A., Etna, M. P., Rizzo, F., Fiore, S., Ricci, D., Iannetta, M., Sinigaglia, A., Lodi, A., Mancini, N., Criscuolo, E., Clementi, M., Andreoni, M., Balducci, S., Barzon, L., Stefanelli, P., Clementi, N. & Coccia, E. M. (2021) Differential plasmacytoid dendritic cell phenotype and type I Interferon response in asymptomatic and severe COVID-19 infection. PLoS pathogens, 17 e1009878.
Silva-Sanchez, A. & Randall, T. D. (2020) Anatomical Uniqueness of the Mucosal Immune System (GALT, NALT, iBALT) for the Induction and Regulation of Mucosal Immunity and Tolerance. Mucosal Vaccines, 21.
Steiner, S., Schwarz, T. & Corman, V. M. (2021) Reactive T Cells in Convalescent COVID-19 Patients With Negative SARS-CoV-2 Antibody Serology. Frontiers in immunology, 12 2557.
Swadling, L., Diniz, M. O., Schmidt, N. M. & others (2022) Pre-existing polymerase-specific T cells expand in abortive seronegative SARS-CoV-2 – Nature. Nature, 601 110—117.
Tallóczy, Z., Jiang, W., & Virgin, H. W. (2002). Regulation of starvation- and virus-induced autophagy by the eif2α kinase signaling pathway. Proceedings of the National Academy of Sciences, 99(1), 190–195.
Tang, F., Xin, Z.-T. & others (2011) Lack of Peripheral Memory B Cell Responses in Recovered Patients with Severe Acute Respiratory Syndrome: A Six-Year Follow-Up Study. J. Immunol. 186 7264—7268.
Uematsu, S., Fujimoto, K., Jang, M. H., Yang, B.-G., Jung, Y.-J., Nishiyama, M., Sato, S., Tsujimura, T., Yamamoto, M., Yokota, Y., Kiyono, H., Miyasaka, M., Ishii, K. J. & Akira, S. (2008) Regulation of humoral and cellular gut immunity by lamina propria dendritic cells expressing Toll-like receptor 5. Nature Immunology, 9 769–776.
Wang, Z., Lorenzi, J. C. C., Muecksch, F. & others (2021) Enhanced SARS-CoV-2 neutralization by dimeric IgA. Sci. Transl. Med. 13.
Wu, R.-Q., Zhang, D.-F., Tu, E., Chen, Q.-M. & Chen, W. (2014) The mucosal immune system in the oral cavity—an orchestra of T cell diversity. International Journal of Oral Science, 6 125—132.
Xu, M. L., Wi, G. R., Kim, H. J. & Kim, H.-J. (2016) Ameliorating Effect of Dietary Xylitol on Human Respiratory Syncytial Virus (hRSV) Infection. Biological and Pharmaceutical Bulletin, 39 540—546.
Yamada, T., Sato, S., Sotoyama, Y. & others (2021) RIG-I triggers a signaling-abortive anti-SARS-CoV-2 defense in human lung cells – Nature Immunology.
Yang, L.-T., Peng, H., Zhu, Z.-L. & others (2006) Long-lived effector/central memory T-cell responses to severe acute respiratory syndrome coronavirus (SARS-CoV) S antigen in recovered SARS patients. Clinical Immunology (Orlando, Fla.), 120 171.
Zingaropoli, M. A., Nijhawan, P., Carraro, A., Pasculli, P., Zuccalà, P., Perri, V., Marocco, R., Kertusha, B., Siccardi, G., Del Borgo, C., Curtolo, A., Ajassa, C., Iannetta, M., Ciardi, M. R., Mastroianni, C. M. & Lichtner, M. (2021) Increased sCD163 and sCD14 Plasmatic Levels and Depletion of Peripheral Blood Pro-Inflammatory Monocytes, Myeloid and Plasmacytoid Dendritic Cells in Patients With Severe COVID-19 Pneumonia. Frontiers in immunology, 12.
Zhou, D., Li, P., & Lin, Y. (2005). Lamp-2a Facilitates MHC Class II Presentation of Cytoplasmic Antigens. Immunity, 22(5), 571–581.

Deja una respuesta