Fundamentos científicos para el uso de POLYACTIL-N gel, PETROACTIL y SEDACTIL en Dermatología
Febrero de 2008
Introducción
En manera elemental un buen cosmético o, tal vez, un buen cosmocéutico, lo que necesita operar para que la piel se mantenga en estado de salud, es equilibrar la retención de agua desde el estrato basal al estrato córneo en manera creciente (ver gráfico)
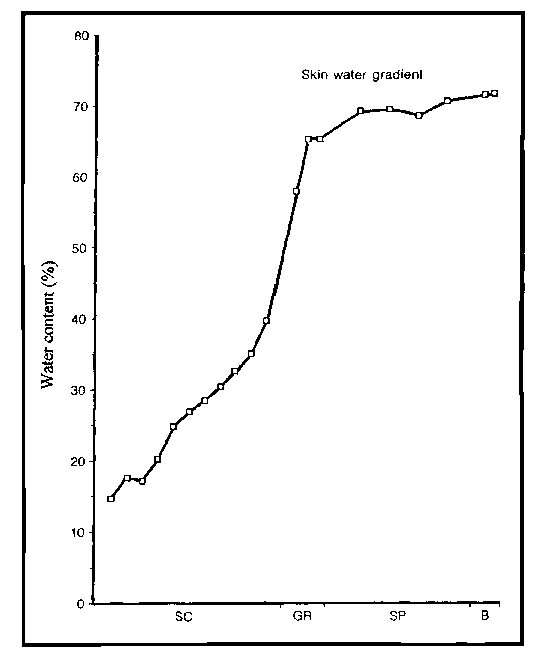
Contenido de agua de los estratos de la piel: (SC: estrato córneo; GR: estrato granuloso; SP: estrt. Espinosos; B: estr. Basal)
de abajo hacia arriba y adicionalmente mantener intactos el manto aéreo, la emulsión epicutánea y el manto ácido.
En cuanto a retención de agua a continuación se analizan los factores críticos en preservar el agua en la piel y su turgencia, vistos los eventos críticos en lesiones mayores y cómo esos mismos principios son aplicables a la simple estética o el mantenimiento de la substancia o grosor dérmico por buena reposición de matriz extracelular (ECM) y queratinicítica.
Balance hídrico de la piel y PETROACTIL
Amplia experiencia que se ha acumulado demuestra que heridas crónicas donde no se mantiene una función del balance hídrico en la herida y no se abastece de niveles adecuados de glicerol, muestran grandes dificultades en su re-epitelización o si llegan a cerrar, lo hacen en forma muy precaria.
La importancia del balance susodicho se ha comprendido mejor desde que se descubrieron las acuaporinas. Estas son una familia de proteínas de escaso peso molecular (~30kDa/monómero) y que se expresan ampliamente tanto en el reino animal como en el vegetal, y de las cuales, 13 de estas que se identificado en mamíferos[1],[2]. Se expresan en varios epitelios y en el endotelio, y ejercen la función de regular el transporte hídrico. Pero también se expresan en tejidos donde originalmente no se pensó que fuera importante el transporte hídrico, como en los queratinocitos de la piel de los mamíferos. Hoy por hoy se ha identificado la expresión de la AQP3 en el estrato basal de queratinocitos de la piel de los mamíferos entre otras[3].
La importancia del balance hídrico en una herida se ha comprendido mejor cuando se reconoció experimentalmente que ratones modificados genéticamente y que carecen de la AQP3, tienen atrasos relevantes en la cicatrización de la piel respecto de los ratones silvestres[4],[5]. La deposición de matriz extracelular (ECM) y la re-epitelización, eventos cardinales en la cicatrización, demandan la migración de respectivos fibroblastos y queratinocitos para completar esa labor.
Esta función también es clara en células endoteliales cultivadas, las cuales si son carentes de la AQP1 demuestran lentitud en migrar hacia una sustancia quimo-atrayente (suero bovino fetal) en la cámara de Boyden comparativamente a células endoteliales normales. Mayores aún son las diferencias en ensayos “invasivos” en los cuales se hacen migrar las células a través de un Matrigel. Las deficiencias del transporte de agua acuoporina-dependiente, puede repercutir en la habilidad de las células migratorias en efectuar rápidos cambios locales de volumen trans-membranosos y de flujos iónicos que están a la base en la formación de las prominencias transitorias de la membrana que se convierten en lamelopodios y arrugas del borde puntero de la célula y que la ponen en movimiento[6],[7].
Si a células epiteliales tipo CHO y FRT nulas en AQP se les provee de AQP1 o AQP4 de origen exógeno mediante un filtro poroso, es posible observar su migración y como confluyen a cerrar una herida in vitro. Lo anterior sugiere que el efecto cicatrizante no es específico de un tipo de célula ni de un tipo de AQP. Es más, en muchos tipos de células la AQP1 se localiza en el borde puntero de las mismas, sitio donde concurren los canales intercambiadores de Na+/H+ y Cl-/HCO3, y co-transportadores de Na+/HCO3 que se involucran en animar la migración celular. Mediante la video microscopía de retardo mínimo es posible observar que la expresión de AQP1 produce más lamelopodios y que duran menos tiempo, lo que sugiere un recambio más rápido de las prominencias que animan la migración celular[8]. Lo anterior sugiere que las AQPs aceleran la migración celular facilitando el recambio de las prominencias de la membrana de lado puntero de su eje.
El desdoblamiento de la actina, de la cual es rico el lamelopodio, y la captación de iones por el vértice de la célula, puede crear gradientes osmóticos locales que activan el influjo de agua a través de la membrana y la dinámica de motilidad de la célula. El aumento de la presión hidrostática crea las prominencias de la membrana y espacio para la polimerización de la actina[9]. El proceso también ha sido llamado osmoforesis visto que el flujo de agua del vértice tiende a migrar hacia el lado postrero de la célula buscando hipo-osmolalidad y así crea la motilidad[10]. Los cambios osmóticos dan el espacio para que los filamentos de actina se polaricen al desarrollar formaciones ramificadas que semejan un alambre de púa y que crecen rápidamente, mientras que a cierta distancia la parte terminal punteada que crece muy lentamente, pero entre ellas se establece una polaridad (las ramificaciones tienden a curvarse hacia la punta y luego replegarse) que se traduce en fuerza cohesiva y gasto de energía libre que logra empujar a la membrana. Los filamentos se organizan un poco distintamente según el tipo de prominencia: en los lamelopodios forman una trama tipo dendrítico mientras que los filopodios se organizan en fajos paralelos elongados[11].

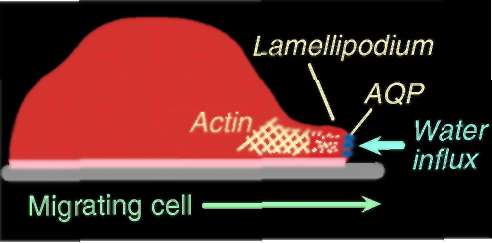
Fig 2
En lo tocante a cicatrización en piel, la agilización de motilidad celular tiene que estar relacionada necesariamente con migración de fibroblastos y queratinocitos, e ineludiblemente impulsada mediante la AQP3; la única acuoporina presente en queratinocitos humanos. Experimentos en ratones sin pelo que son nulos en AQP3, muestran una disminución de la hidratación del estrato corneo y cicatrización retardada[12].
Cong Cao et al, esclarecieron recientemente que la AQP3 se expresa en fibroblastos humanos y que el factor de crecimiento epidérmico (EGF), que estimula la migración celular, también induce la expresión de la AQP3, sea en fibroblastos de piel que en queratinocitos[13]. No existen bloqueadores específicos de la AQP3 para estudiar el fenómeno inverso, pero se ha conocido recientemente que el CuSO4 o NiCl2 inhiben sea el transporte de agua y glicerol de la AQP3[14], [15]. Estos químicos aplicados a los experimentos de Cong Cao et al, demostraron una marcada inhibición de la migración estimulada por EGF en modalidad dosis dependiente. El CuSO4 se demostró más potente en ejercer esa inhibición. Estos resultados además concuerdan con otros que demuestran que la sobre estimulación de las AQPs están involucradas en muchos procesos fisiológicos y patológicos que incluyen la migración celular. Por ejemplo, la AQP4 se encuentra en hiperactividad en cicatrices gliales y las células astrogliales en acelerada migración, como respuesta a trauma craneal in vivo[16]. Otros estudios demuestran que la supresión de AQP1 en ratones disminuye la migración de las células endoteliales de la aorta (in vitro e in vivo), y que transfección de AQP1 y AQP4 funcionales acelera la migración de fibroblastos cultivados del ovario de hamsters chinos y de células Fisher de la tiroides de ratas[17].
Cong Cao et al, concluyen que sus experimentos muestran que el EGF aumenta la expresión de la AQP3 la cual se involucra en la migración de fibroblastos y queratinocitos humanos. Sugieren que el mecanismo de activación es mediante la estimulación de EGFR (receptor del factor de crecimiento epidérmico), ERK (quinasa extracelular regulada por señalización) y P13K (quinasa fosfatidilinositol 3) las cuales inducen la expresión de la AQP3 y la migración fibroblástica. Es reconocido además el rol esencial del EGFR en funciones epidérmicas que incluyen migración celular y cicatrización.
Estudios anteriores al de Cong Gao et al, enfatizaron la importancia del EGF en mejorar la cicatrización de heridas simuladas in vitro, mediante la estimulación del EGF y la facilitación de motilidad de fibroblastos CV-1. Los efectos persistentes del EGF pudieron ser bloqueados por inhibidores de transcripción y de traslación[18]. Muy interesante fue la observación sobre la necesidad de estimular los fibroblastos en presencia de suero de ternero, dando crédito a observaciones hechas en 1984 en Harvard University sobre el factor de respuesta al suero SRF[19].
Efectos de reposición de glicerol
Los ratones que son nulos en AQP3, tienen un contenido bajo de agua/glicerol en el estrato corneo y retraso importante en la recuperación de la barrera luego de pruebas de abrasión de la piel. El contenido de glicerol en el estrato corneo de estos animales es un tercio de lo normal, mientras que la estructura del SC, la composición proteína/lípido y ión/osmolito se encuentran en límites normales.
La reposición de glicerol en animales nulos de AQP3, corrige los defectos de barrera cutánea medidos por conductancia de la piel y acumulación del isótopo 3H2O. La reposición puede ser por vía oral o tópica. Los animales nulos en AQP3 mostraron cantidades similares de glicerol y agua en el SC después de la reposición y restitución de la elasticidad de la piel a las pruebas de succión y en la pérdida de agua transcutánea. El defecto no pudo ser corregido con osmolitas similares al glicerol; como el xilitol, eritrol y propanediol. Analizando la quinética de [14C]glicerol es posible determinar que en los animales nulos de AQP3 existe un transporte disminuido de la sangre al SC, el cual disminuye la síntesis bio-lipídica de la piel. Estos datos aportan la evidencia de que el glicerol es un elemento determinante en la retención de agua por parte del SC y en conferirle a la piel sus cualidades bio-mecánicas (ref n° 5).
PETROACTIL es una formulación dirigida a restablecer el balance agua/glicerol del SC mediante entrega del glicerol por vía tópica y que se vale del efecto oclusivo muy especial del petrolato para facilitar dicha entrega. Según ha sido posible observar en la práctica, los queratinocitos en heridas tratadas con PETROACTIL muestran claras señas de actividad migratoria y de que se facilita su migración sobre el lecho. Con el uso continuado y diligente de PETROACTIL es posible mantener dicha actividad en forma muy satisfactoria, hasta cubrir el defecto.
Función del Petrolato en mantener la barrera cutánea
El Petrolato ha sido estudiado y utilizado ampliamente, en el uso popular, o como un ingrediente de cremas y formulaciones de bajo precio. Todos los estudios lo destacan como el mejor agente para mantener la piel hidratada y turgente. Se discute ampliamente, sin que se llegue a un acuerdo general, si ese fecto es debido a la reposición en el estrato córneo de hidrocarburos parafinados de 15 a 35 carbonos y sobremanera los n-alcanos lineales los cuales se encuentran en la vaselina y contrariamente a los que contiene cadenas laterales como los aceites minerales. La discusión gira en torno al origen de los n-alcanos en el estrato córneo, si son contaminantes o por el contrario autóctonos de la piel. Quienes los consideran exógenos se sienten temerosos de que pueden causar trastornos, de manera especial en pieles con tendencia a la ictiosis o a la descamación. La cantidad determinable es entre un 0.5% y un 1.7% de los lípidos totales (Bortz JT, 1990)[20].
No obstante todos los estudios, anotan la superioridad del petrolato en mantener la piel hidratada. El problema es que usar simplemente vaselina, no es agradable y por eso es descartada por casi todos los dermatólogos y los mismos pacientes. PETROACTIL, soluciona ese problema ya que el uso del lipogel es totalmente lo opuesto y la sensación que deja en la piel está libre de toda untuosidad y es más bien agradable, dejando una sensación de capa de protección y de turgencia por varias horas.
Esta superioridad ha sido demostrada científicamente, pero la sensación desagradable que deja la aplicación del petrolato ha sido un factor de fuerte desmotivación para su empleo en mayor escala. Vale la pena profundizar sobre este aspecto.
Si se extraen para su estudio en humanos los lipidos en forma diferenciada a lo largo del espesor de la piel desde los estratos germinativos, de diferenciación y hasta los de cornificación plena, es posible observar que la predominancia de fosfolípidos y triglicéridos de los estratos más basales cambia a una predominancia de lipidos neutros, ácidos grasos saturados y esfingolípidos hacia la superficie. Pero también en todos los estratos de la epidermis se encuentran los n-alcanos y los escualenos. Lo que hace poco probable por estar estos presentes en los estratos vivos de la piel que su origen sea de índole exógeno[21].[22].
Además el espectro de los n-alcanos de la piel humana no coincide con el espectro de los hidrocarburos que se encuentran habitualmente en el aire[23]. La presencia de una combinación de hidrocarburos de cadenas pares e impares en los alcanos de la piel excluye el origen por no-metabolización de hidrocarburos de origen alimentario los cuales son casi exclusivamente impares[24]. Las cuantificaciones de lipidos de estos estudios fueron hechas en especímenes de piel humana sin tratamiento previo con emolientes que contuvieran hidrocarburos. El hecho que en ictiosis lamelar el contenido de n-alcanos está elevado, es para los autores citados evidencia de que la epidermis los
sintetiza. Si bien no ha sido posible dar con evidencia directa de lo anterior, lo apuntado inclina a pensar que de alguna manera existe dicha función en la epidermis[25].
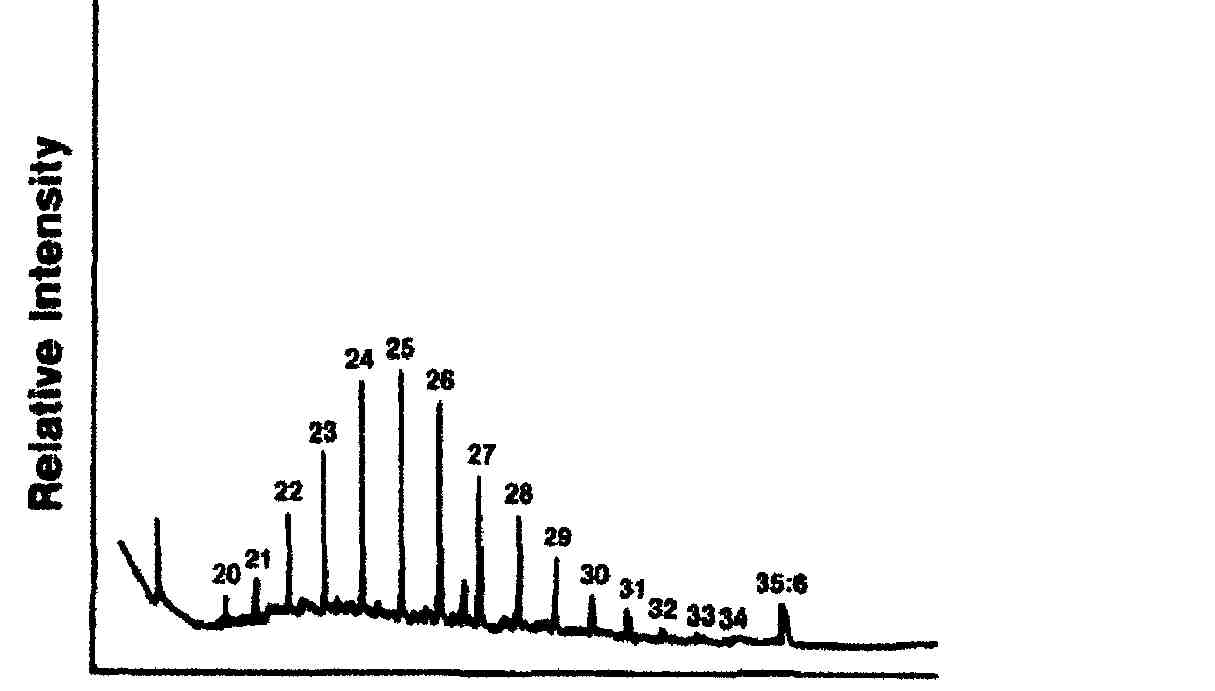 Aún más interesante resulta comparar el espectro de los n-alcanos del estrato córneo de la piel humana, con el de petrolato, el Eucerin, la lanolina y HEB los cuales coinciden en el caso de petrolato especialmente y en segundo lugar con el de Eucerin[26].
Aún más interesante resulta comparar el espectro de los n-alcanos del estrato córneo de la piel humana, con el de petrolato, el Eucerin, la lanolina y HEB los cuales coinciden en el caso de petrolato especialmente y en segundo lugar con el de Eucerin[26].
Fig. 3. Perfil capilar de la fracción n-alcano de piel humana, distribución a manera de campana C19 a C34, con repartición equitativa de cadenas par e impar, (tomado de cita #22).
EUCERIN HEB
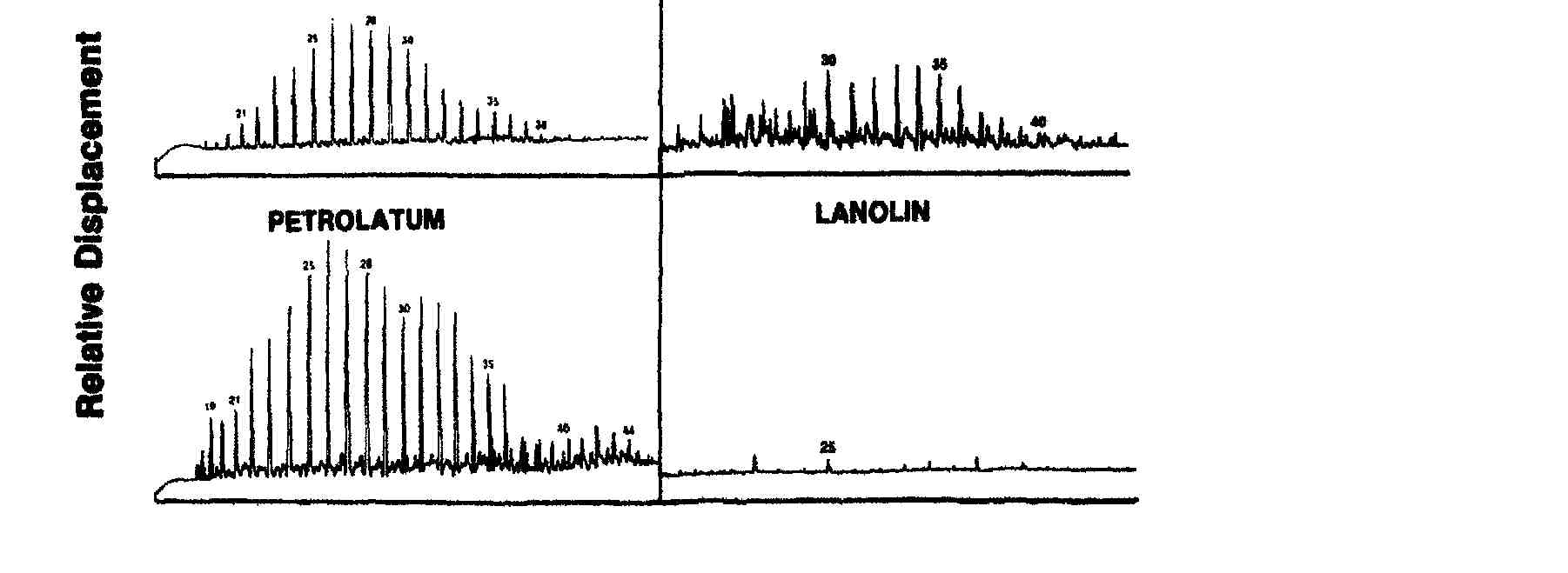
Retention Time (Rj)
Fig. 4. Asombrosa similitud de petrolato en la distribución de n-alcanos con la piel normal, (tomado de cita #22).
Cuando se estudian los lípidos en el estrato córneo y se relacionan con permeabilidad, es interesante notar que existe una relación esfingolípido/lípido neutro y que si bien en ella predominan los esfmgolípidos (con un 80% ceramidas), son los lípidos neutros los que determinan la relativa impermeabilidad del estrato córneo. Los esfmgolípidos son más estables y los lípidos neutros más fugaces. Lo que quiere decir que si se pierden lípidos neutros la piel pierde más agua y la retiene menos. Siendo más fugaces, se deduce que entonces son la fracción a reponer. La relación también es posible observarla como varía similarmente según la relación EL/LP en 4 tipos de piel: en cara, abdomen, pierna y planta del pie, (ver cita 26)
Fundamentalmente se explica la superioridad observada, al aceptar los n-alcanos como material oclusivo de penetración específica en los intersticios del estrato córneo, pero que no se extiende hacia los estratos nucleados más profundos. Cuando se aplica este material, es como cubrir la piel con una membrana permeable al vapor de agua. O sea, una oclusión que respira.
Estos hidrocarburos son considerados elementos no-fisiológicos pero que ofrecen ventajas sobre los fisiológicos, como en el caso del ácido linoléico. Lo anterior se explica si consideramos que los hidrocarburos lineales de diversa longitud, par e impar, se intercalan en el espacio intercelular del estrato córneo y, al carecer de cadenas laterales, se empaquetan entre sí sellando el espacio intercelular pero dejando asimismo cierta transpiración entre moléculas. No penetran hacia los estratos nucleados. El efecto de recuperación de barrera se advierte de inmediato, ya que ocupan el espacio intercelular directamente y son semejantes a los n-alcanos de la piel. Visto desde ese ángulo, es el material ideal para conservar la barrera cutánea sin retardar la recuperación de los estratos germinales subyacentes[27].
Mientras que los lípidos fisiológicos penetran a todo espesor y se incorporan a los estratos nucleados y al sistema de secreción propio del cuerpo lamelar. Por tanto retardan la recuperación de la disfunción o el desajuste de la barrera cutánea, en 2hrs. La recuperación no se advierte hasta que los lípidos despejen el proceso de secreción y se secreten en el espacio intercelular del estrato córneo[28].
Según los conceptos anteriormente expuestos es más específico para efectos de la cosmetología la función del petrolato que la de la glicerina; o de tantos otros cosmocéuticos. Pero si se integran en una base emulsificable ambos componentes como en el PETROACTIL, el hecho se convierte en una novedad fascinante, tanto para la preservación de la barrera cutánea como para tratar condiciones dermatológicas. En las secciones anteriores de esta monografía se comprende cómo es posible recuperar los estratos germinativos, si se mantiene una hidratación correcta del estrato córneo y que en este caso se logra con el efecto oclusivo tan especial de los n-alcanos. También es lícito pensar que esta recuperación se relaciona con el efecto que este producto en particular posee sobre las acuaporinas y la especial cicatrización que se observa con su utilización (ver pag. #11). El producto es inigualable para restaurar manos dañadas y lo mismo para pies maltratados. Puede combinarse con POLYACTIL-N gel regular. Ver instrucciones aparte.
Defensa innata de la piel
La integridad anatómica de la epidermis, el equilibrio de la barrera cutánea, o es decir, del manto aéreo, de la emulsión epicutánea y del manto ácido, constituyen en conjunto una defensa natural del cuerpo humano hacia las múltiples cepas de bacterias con las que debemos relacionarnos y a los cuales estamos expuestos constantemente. Si el sistema de defensa se mantiene en equilibrio dinámico, merma la probabilidad de que se adhieran microorganismos patógenos a la piel.
Esta exposición comienza cuando el neonato se enfrenta a un medio ambiente donde pululan cantidades enormes de microorganismos. La colonización continúa durante la vida por inhalación, deglución y el contacto con la piel. Se forman nichos particulares entre una diversidad de microbios y las células del hospedero, para constituir la flora comensal y que en conjunto establece una barrera de defensa. Se incluyen estafilococs coagulasa-negativos, micrococos, corynebacteria,propionibacteria, lactobacilli y levaduras. Los microbios que no encuentran un nicho en el hospedero, sea por competencia o por suceptibilidad a las defensas del hospedero, se consideran «transitorios».
De tal manera que no se encuentran microbios en los músculos, las articulaciones, el tejido conectivo o en los órganos vitales. Contrariamente, existen complejas comunidades en la piel, la nasofaringe, el aparato respiratorio alto, la boca, el intestino grueso y la vagina. Existe en estos sitios colonización a pesar de que poseen ambientes desfavorables. En la piel, el pH más bajo no lo toleran muchos microbios pero siempre hay colonización. Como también los lípidos que se producen en la piel, o que son metabilizados por propionebacteria, y algunos polipéptidos inhiben estos también las bacterias.
Los microbios que superan esas barreras se consideran «patógenos» pero los cuales normalmente están en contacto con el hospedero, como S. aureus, Streptococcus pneumoniae, Hemophilus influenza o Escherichia coli y se consideran «oportunísticos» ya que prosperan cuando el hospedero se encuentra inmunocomprometido. Luego están los patógenos que normalmente no están en contacto con el hospedero excepto cuando causan enfermedad; se consideran obligados».
Si bien lípidos y polipéptidos contribuyen en la piel a la barrera descrita y a mantener los microbios controlados, a efectos de la presente monografía interesa revisar el efecto que pueden tener los primeros para mantener la piel libre de patógenos. Escapa a este texto también lo que sucede si se supera la barrera y como funciona todo el aparato de defensa innata de la piel para lo cual existen excelentes revisiones de la literatura y a las cuales remitimos.
Para efectos de lo apuntado, es muy interesante ver lo que sucede con el neonato y como arriba protegido a este mundo, procedente de un ambiente intrauterino prácticamente privo de microbios y cómo se expone gradualmente a la carga bacteriana luego de nacer. Lo protección al nacer es asaz necesaria, en vista de que su aparato inmunitario adquirido se encuentra todavía inmaduro.
Tardíamente durante la gestación, se forma un material protector que se deposita sobre el feto y se llama «vernix caseosa». Se ha identificado que está compuesta por líquido amniótico, lípidos y polipéptidos y ha sido reconocida como una barrera mecánica y química que protege al feto durante el parto y los primeros días de vida.
La función antibacteriana de los lípidos de la piel, la pilo-sebácea y de la vernix caseosa, ha sido estudiada y reconocida. La pilo-sebacea contiene 13% de ceramidas, 47% ácidos grasos, 7% colesterol 11% escualenos y 17% de ceras esterificadas. La vernix caseosa contiene[29]:
Polipéptidos 10.3%
 Otros lípidos son:
Otros lípidos son:
Ésteres de cera.
Ësteres esterólicos.
Escualeno
Triglicéridos.
Esteroles libres
Lípidos de membrana: Colesterol 1.1%
Ceramidas 0.7%
Ácidos grasos libres 0.6% Fosfolipidos 0.4%
Fig. 5 Pickens et al (2002) y Hoeger et al. (2002)
Con respecto a la inferencia que lo anterior conlleva sobre el PETROACTIL, se resume principalmente en la eficacia que escualenos y n-alcanos pueden tener para preservar la piel libre de patógenos. Desafortunadamente la mayoría de los autores no analizan la proporción de n-alcanos contenida en los escualenos C30H50. Las longitudes de los n-alcanos son parecidas solamente que invariablemente son saturados. No obstante la experiencia con PETROACTIL ha sido excelente en cuanto a mantener las áreas tratadas libre de patógenos.
Adicionalmente a la eventualidad de si el producto tiene acción antibacteriana directa o menos, está el hecho que mantiene la integridad anatómica piel y de sus anexos suaves, como lo son el manto aéreo y la emulsión epicutánea perfectamente equilibrados. Esa acción integrada refuerza la función de barrera, no solamente por cuanto a la pérdida de agua se refiere, pero también como defensa hacia la adherencia de los patógenos.
Función búfer y mantenimiento del manto aéreo, emulsión epicutánea y manto ácido.
No se le ha prestado atención suficiente al mantenimiento del pH en la piel y cómo puede incidir un pH desbalanceado en favorecer piel reseca y dañada, Sea POLYACTIL-N Petrolato que POLYACTIL-N gel contienen un búfer muy eficaz que mantiene el pH apropiado de la piel. Se trata de un grupo de sales GRAS (Generally Regarded as Safe) con base orgánica de hidrógenos metílicos que se combinan con cationes inorgánicos. Las sales carecen de toda toxicidad.
Sin un equilibrio en la epidermis en lo tocante a su composición lipídica, retención de agua y pH, no es posible obtener la estabilización de la emulsión epicutánea; formada por agua que proviene del sudor y la perspiración insensible y lo lípidos de las glándulas sebáceas y los que derivan del proceso de queratinización. El pH es moderadamente ácido (Orlandi, 2004)[30]. O mejor, si no hay integridad de la barrera anatómica, no puede conservarse la barrera epicutánea y aérea, lo que apresura los efectos nocivos sobre la piel. Finalmente la homesotasis del pH hace parte también de la barrera.
Es notable la eficacia de PETROACTIL en preservar la barrera cutánea intacta y lo agradable que es el uso de este producto.
Antiinflamación
POLYACTIL-N gel es además un agente antiinflamatorio notable. Esta aseveración deriva más quer de la práctica y los resultados tan evidentes que se han constatado con el uso del producto. El producto tiene más de 6 años de comercializarse y durante el uso ha salido a relucir que el producto posee notables propiedades antiinflamatorias.
En vista de lo anterior, se ha sometido el búfer contenido en el producto a diversos análisis. Mucha de la información relativa a esta faceta, es confidencial, en vista de que se presentará un patente sobre este atributo. No obstante es posible adelantar que el búfer tiene capacidad de influir sobre el núcleo celular en una diversidad de maneras que inducirían un fenotipo antiinflamatorio en lo tejidos tratados con el producto.
Basta intentar su uso en condiciones de inflamación de la piel y darse cuenta de la eficacia del producto. Lamentamos no poder proporcionar más información al respecto.
Cicatrización morfogenética
En la figura siguiente se muestra el lugar de origen de células madre foliculares y la importancia que tiene el folículo en reparar, sea lesiones mayores, que simplemente piel dañada. Es fácil comprender que si la migración de elementos nuevos se facilita como se explicó anteriormente, el potencial de PETROACTIL en Deramtología es aparente. Cultivos de células extraídas de la «bulge región» expresan los marcadores K19 e integrina β1 que son típicos de las células madre adultas foliculares[31]. A juzgar por el tipo que se observa en heridas cicatrizadas con el uso de POLYACTIL-N gel y PETROACTIL es muy probable que el producto estimule la protuberancia y que las células madre foliculares adultas migren hacia los focos de lesión, de manera que la reparación se obtiene con casi total ausencia de cicatriz fibrosa. O mejor, en la experiencia de tatrar lesiones mayores con estos productos ha sido posible observar reparaciones que conservan rasgos de morfogénesis.
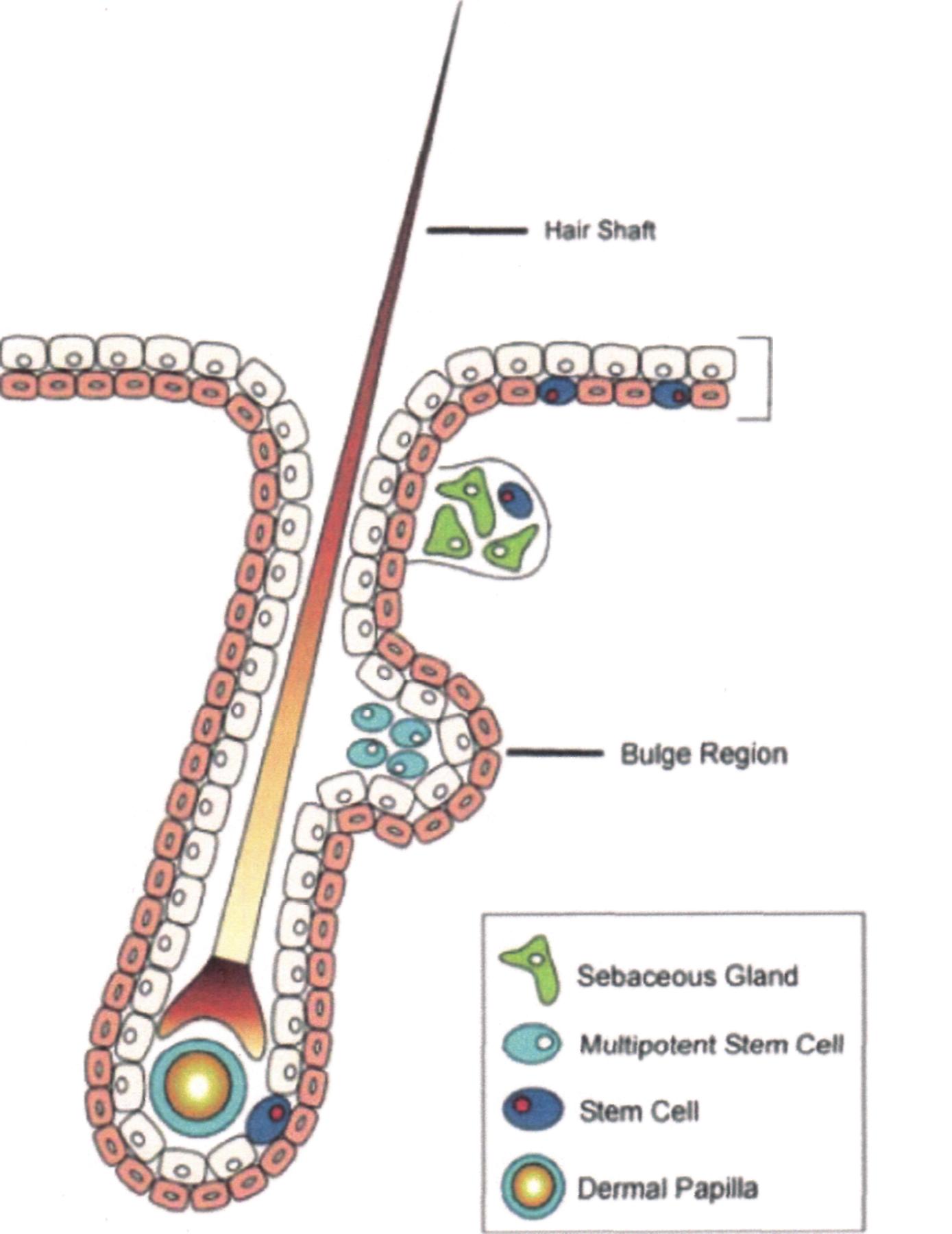 Fig. 6.
Fig. 6.
La imagen ilustra el tipo de reparación que se obtiene con el uso de los productos referidos en este documento.
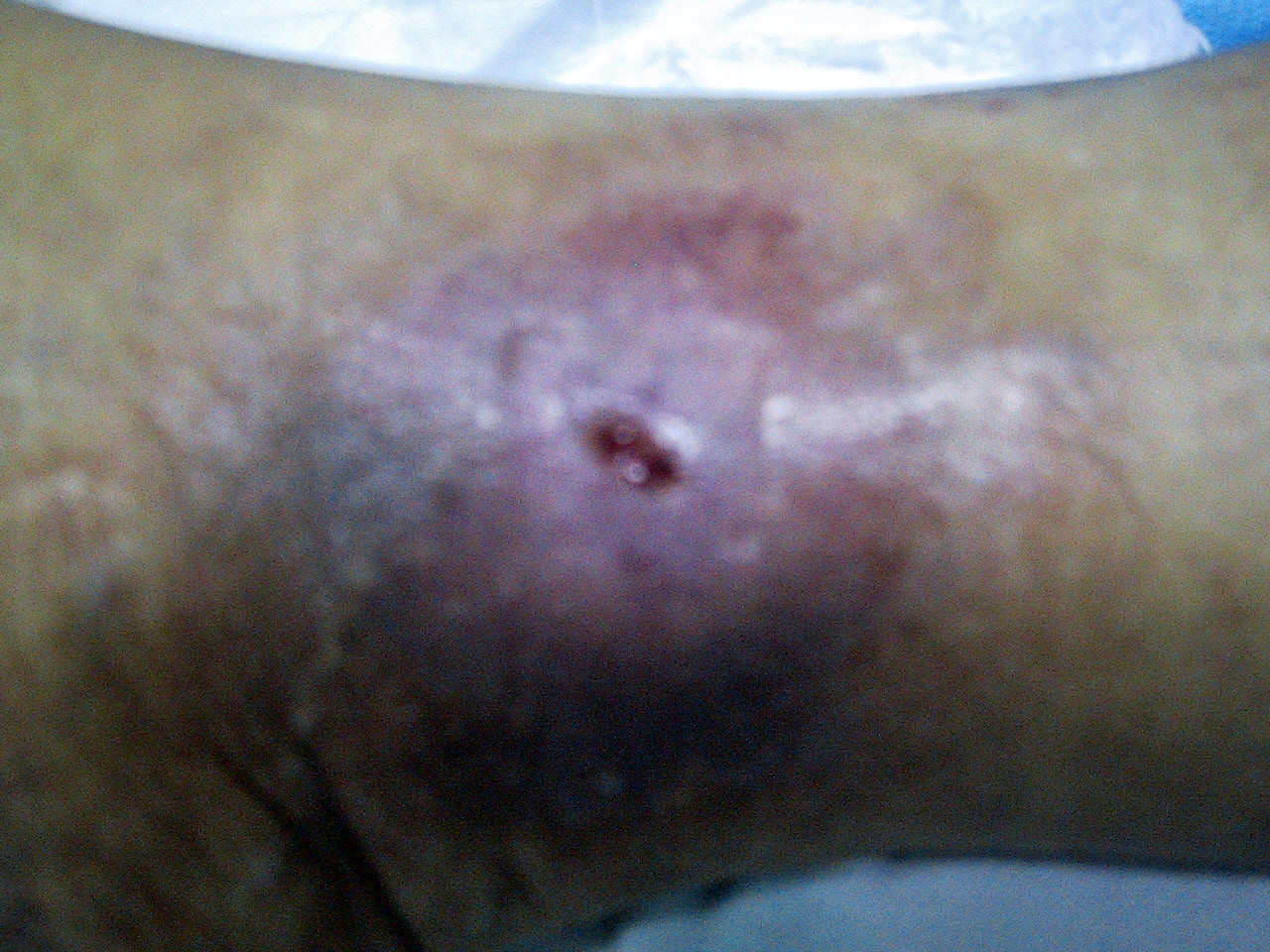

La fotografía a la derecha se obtuvo después de 6 meses del cierre de la lesión. La paciente continuó usando los productos sobre la reparación con el fin de mejorar el aspecto de la piel.
La práctica parece corroborar, que si estos productos son aptos para la cicatrización en forma tan evidente y eficaz, también lo son para reparar la piel o mantenerla en óptimas condiciones. La ausencia de toxicidad en estos productos es otro gran activo y su utilidad en pieles sensibles y con tendencia a la atopia. Esto ha sido confirmado por un grupo pequeño de dermatólogos, quienes han incorporado estos productos a su vademécum, lo cual ha animado a MED Química a confeccionar este folleto dirigido a la respetable comunidad de dermatólogos.
Dominio en controlar el Acné
El Acné está causado por un bloqueo de los folículos pilosos de la piel. El bloqueo se debe a una excesiva producción de sebo (aceite) a cargo de las glándulas sebáceas y/o desprendimiento de células en el folículo y su acumulación junto con polvo. La mezcla funciona como un tapón que impide el drenaje natural del folículo a nivel del orificio de salida.
El atascamiento de secreciones y residuos estimula un crecimiento excesivo de las bacterias comensales de la piel l’ropiombactenum acnes La bacteria produce químicos en exceso que alteran la composición normal del aceite cutáneo, de manera que las grasas degradadas se vuelven muy irritantes para la piel y causan inflamación.
La piel inflamada se caracteriza por rubor, hinchamiento, calor y dolor. La inflamación ocurre como mecanismo de defensa del sistema inmune para liberarse de una sustancia extraña. La sustancia extraña consta sea de bacterias o de los compuestos irritantes que secretan.
Los poros bloqueados pueden causar:
- Puntos negros o micro-comedones, que usualmente evolucionan hacia un comedón no inflamatorio. Son azules y muy oscuros, debido a la presencia de pigmento (melanina).
- Puntos blancos. Se originan por un bloqueo más profundo del folículo. Del folículo el exceso de aceite se filtra hacia la piel profunda alrededor del poro y causa espinillas coloradas o ciegas blancas. Contrariamente a los puntos negros, los puntos blancos son más propensos a producir inflamación colorada o espinillas.
- Espinillas abscedadas o pústulas. Ocurren cuando las paredes del folículo ceden y se rompen, y el material retenido dentro del folículo se difunde hacia la piel adyacente. Como los estratos de piel más profundos están colonizados por el Propionibacterium acnes se establece entonces el acné inflamatorio.
- Acné inflamatorio severo. Es la intensificación del estadio anterior de manera que se forman nódulos inflamatorios profundos y enquistados. Pueden confluir y conglobarse para establecer lo que se conoce como Acne conglobata, situación en que los nódulos pueden transformarse en senderos sinusoidales. Pueden también evolucionar en Pyoderma facíale, donde se forman pústulas grandes y nódulos foruncoloides. La condición puede diseminarse al pecho y la espalda. Estas fases del Acné pueden finalizar en severas cicatrices de aspecto desagradable.
Como la bacteria involucrada es no-patógena y a lo sumo provoca inflamación del folículo, de leve a severa, es harto evidente que únicamente una droga anti-inflamatoria potente con poder de acción local y ejercido directamente en la zona donde se desarrolla la enfermedad, es capaz de corregir la enfermedad. A pesar de este supuesto el uso de antibióticos orales, peróxidos tópicos, tratamientos hormonales y la isotretinoina oral no han dado prueba de ser capaces de corregir el proceso. La isotretinoina puede significar una leve diferencia en casos muy severos y que no han respondido a ninguna otra medida. Sin embargo los riesgos de usar esta droga son altos y solamente puede ser prescrita por especialistas. Trabaja secando las secreciones oleosas de la glándula sebácea y no tiene ningún efecto directo sobre la inflamación[32].
Las extraordinarias propiedades de POLYACTIL-N gel, se ajustan espléndidamente a vencer el Acné y es incomparable en dominar el trastorno básico, como también las múltiples facetas bajo las cuales se manifiesta la enfermedad. Desde regular la fisiología de la piel en estadios tempranos, a cicatrizar con marcas casi imperceptibles, las incisiones que se requieren para tratar la Acne conglobata y el Pyoderma facíale. Este producto usado solo, o conjuntamente con PETROACTIL en casos más severos, es la mejor arma disponible en el tratamiento del Acné. ¡POLYACTIL-N gel es un hito sin precedentes en el tratamiento del Acné!
Instrucciones:
Lávese la cara y las otras áreas afectadas con simplemente agua; deseablemente bajo la presión de una ducha. Use un algodón pequeño impregnado de gel, para remover las lesiones que se desprenden fácilmente a una frotación leve. ¡No toque estas lesiones con los dedos y uñas! Lávese de nuevo y séquese con un paño. Aplique suficiente gel para cubrir todas las lesiones. Si alrededor y a una cierta distancia de las espinillas existe inflamación, aplique gel adicional sobre la inflamación y frótelo hasta que desaparezca. Repita el procedimiento dos veces al día. En casos más severos, aplique PETROACTIL como segunda aplicación, sobre el área previamente tratada con POLYACTIL-N gel unos 60-90 seg. después de la primera aplicación.
No asocie POLYACTIL-N gel con ningún otro producto excepto PETROACTIL. El meollo del Acné radica en la inflamación del folículo y POLYACTIL-N gel logra dominar el trastorno de fondo satisfactoriamente.
Homeostasis de la barrera cutánea e inmunidad tópica
Hasta aquí se han considerado los aspectos reparativos en las condiciones que pueden afectar a la piel con pérdida de su barrera cutánea, sea en su dimensión más superficial que se circunscribe al estrato córneo, como en trastornos más comprometedores donde se involucra la integridad del espesor vivo epitelial y de la lámina basal. Es posible observar esta acción reparativa, sea en las condiciones originadas por trauma como por causas patológicas.
Dichos aspectos encuentran solución con el uso de POLYACTIL-N gel o PETROACTIL, como también mediante su uso combinado. Fundamentalmente destacan en la acción reparativa factores positivos, como son la resolución de la inflamación, la cicatrización regenerativa y el control de la infección los cuales posibilitan que la piel recupere un aspecto muy cercano al previo.
Hasta el momento por lo apuntado, no han aparecido en escena los lípidos así llamados “fisiológicos” y la restitución del estrato córneo se ha operado solamente utilizando los “no fisiológicos” más principios de cicatrización avanzados y sobre los cuales ampliamente se dieron justificaciones. Para mantener la homeostasis de la barrera cutánea se propone el uso de SEDACTIL, diseñado para mantener la homeostasis de la barrera cutánea con integridad e hidratación ideal del estrato córneo e intensificación de la inmunidad tópica de la epidermis viva; en sus estratos epiteliales nucleados, basal espinoso y granular. El SEDACTIL contiene algunos lípidos fisiológicos seleccionados.
La posibilidad de suministrar lípidos exógenos para que sean asimilados y procesados por los queratinocitos, abre una posibilidad apasionante en la protección de la piel, sea en lo tocante al mantenimiento de su integridad como barrera física e inmune, pero también en la candente y codiciada instancia de preservar una piel juvenil. Los lípidos suministrados se pueden rastrear al aparto de Golgi en los estratos nucleados y de donde son incorporados al proceso de secreción y son trasladados en organelas para luego formar gránulos lamelares y la extrusión de su contenido al espacio intercelular del estrato córneo, de donde los lípidos procesados son asumidos por los corneocitos de estrato córneo[33].
No obstante el tema de los lípidos de la piel y el papel que juegan en mantener la viabilidad de las células tanto muertas (corneocitos) como vivas (estratos nucleados) es sumamente complejo. Hay, solamente en lípidos, unos 1000 que componen la lipodómica celular. De la misma forma existen dificultades formidables en el diseño de un producto que tenga verdaderas opciones de equilibrar los múltiples factores que influyen en la homeostasis de la barrera cutánea. Diremos solamente que el SEDACTIL posee como base elementos de los productos POLYACTIL-N gel y PETROACTIL y que por lo tanto lleva intrínsecamente un poder reparativo ya bien explicado y justificado, más el poder de equilibrar los microambientes. Al no basar en lípidos la acción reconstructiva, es posible relegar al aparato celular la labor de procesar lo que normalmente acepta como substratos para proveerse de lípidos. De esa manera la célula acomoda de la mejor forma los substratos y los convierte en lípidos perfectamente equilibrados 1:1:1 entre colesterol, ácidos grasos y ceramidas en el estrato córneo.
No solamente, se elige excluir de la formulación a las ceramidas debido a la enorme complejidad de su migración hacia el estrato córneo y la transformación final que sufren en tanto se gesta la maduración queratinocítica. Fundamentalmente se produce una conversión de lípidos precursores polares contenidos en los cuerpos lamelares a lípidos no polares (ceramidas de cadena larga y glucosilceramidas con cadenas de diferente longitud) en el espacio extracelular mediante procesos enzimáticos y donde se depositan. Esto involucra un delicado equilibrio entre el metabolismo de carbohidratos (glicolisis, ciclo tri-carboxílico); metabolismo lipídico con β-oxidación de ácidos grasos, nueva síntesis de ácidos grasos; captación de ácidos grasos esenciales (ac. Linoléico); modificación enzimática de ácidos grasos con serina (aminoácido) para formar lípidos de barrera. Eventualmente se forman las lamelas intercelulares que circundan a los corneocitos y los mantienen en su lugar. Es preferible confiar en la célula para restituirle las ceramidas que requiere el estrato córneo, en caso de haberse producido quebrantamiento de la barrera, en particular porque esta síntesis sucede tardíamente y la suministración pronta de ceramidas surtiría un efecto favorecedor de la diferenciación queratinocítica. Es decir, en el momento en que la demanda de reposición de corneocitos y lamelas está al máximo.se aprovisionaría equivocadamente de elementos de señalización, los cuales frenan y se oponen al proceso de reconstitución de la barrera cutánea. Estudios de [1-14C]-Ac inyectado en epidermis de cerdos permiten rastrear la síntesis en el tiempo de los lípidos de la epidermis. Durante los primeros 2 días se detecta actividad sintética en el colesterol, fosfolípidos y glucosilceramidas. Las ceramidas aparecen después del segundo día[34],[35]. No obstante es posble detectar un aumento del mRNA de la palmitoil transferasa (la primera enzima de la síntesis de los esfingolípidos) a partir de 6 horas luego de la pérdida de barrera[36].
Adicionalmente a la función que juegan como componentes de las lamelas del estrato córneo, que se puede hasta cierto punto calificar como pasiva, está el papel activo que las ceramidas juegan como segundos mensajeros y como componentes del ciclo de las esfingomielinas, llegando a desplegar funciones de señalización celular. Durante el crecimiento celular las ceramidas y la fosfatidilcolina se convierten a esfingomielina por acción de la esfingomielina sintasa. Este proceso decididamente propicia el crecimiento y la supervivencia celular y durante el mismo se acumulan sustancias agonistas del mismo y elementos constructivos de las membranas celulares. Entre los agonistas está el diacilglicerol (DAG) un potente activador mitogénico con acción sobre la cinasa protéica C (PKC), conducente a la supervivencia celular, Véase Fig.
Pero durante condiciones que conllevan al estrés, la esfingomielina es degradada por las fosfolipasas conocidas como esfingomielinasas y se producen ceramidas. De manera que el tipo de señalización que se produce es el opuesto y conducente a la muerte celular programada eventualmente[37]. Las ceramidas se producen en condiciones estresantes como: tratamiento quimioterapéutico[38] o con TNFα[39], activación del antígeno FAS[40] (media la apoptosis), durante la isquemia/re-perfusión, irradiación y tratamiento con corticoesteroides[41]. Por su acumulación en los procesos siguientes, las ceramidas tipifican la señalización del control del ciclo celular, la senescencia y la diferenciación celular[42].
De novo

Degradación
Fig Metabolismo basal de las ceramidas y su interrelación en la seálización celular
Las ceramidas se forman o de novo o por degradación de esfingolípidos complejos (plan horizontal). A su vez pueden ser convertidas en esfingosina (Sph) o pasan a ser substrato para la síntesis de esfingomielina (SM), generando diacilglicerol o glicolípidos. Cada lípido bioactivo puede entonces generar efectos específicos (plano vertical). PalCoA, palmitoil-CoA; DHS, dihidroesfingosina; PA, ácido fosfatídico; SMS, sintasa SM; DGK, DAGcinasa; SL, esfingolípido.
Tomado de Yusuf A. Hannun‡ and Lina M. Obeid The Ceramide-centric Universe of Lipid-mediated CellRegulation THE JOURNAL OF BIOLOGICAL CHEMISTRY Vol. 277, No. 29, Issue of July 19, pp. 25847–25850, 2002
Otra razón que justifica omisión de las ceramidas en el SEDACTIL, es la facilidad con que se logra su producción a cargo de los queratinocitos si se les surte de ácidos grasos libres saturados, como el ácido esteárico y palmítico. Las experiencia con análogos cultivados de piel, ilustran muy bien esta relación.
Los análogos de piel cultivada, no mantienen una barrera cutánea adecuada y son deficientes en ceramidas. Desde principios de lo años 80, se conoce el hecho que la barrera de estos sustitutos puede mejorarse enormemente cuando se cultivan en presencia de ácidos grasos esenciales (que en el organismos son captados en la sangre y son de origen dietético) y ácidos grasos no esenciales. No solamente, todas las células producen ceramidas y su acumulación excesiva es causa de muchos trastornos. Para mencionar un ejemplo, la acumulación de ceramidas en el músculo esquelético aumenta la resistencia a la insulina. La mejor forma para estudiar experimentalmente este efecto sobre la resistencia a la insulina es encubando miotubos en suero con albúmina bovina y palmitato y estearato. Los miotubos que más expresan el problema son los que se les proveen de palmitato y estearato y producen hasta 5 veces más sobre el nivel basal[43].
La permeabilidad del estrato córneo depende de la organización que los lípidos extracelulares asumen las cadenas aciles en su empacamiento lateral. Cuando la distancia entre cadenas no está bien definida se dice que están en una fase líquida. Si la distancia es la misma (0.41µm) entre su eje x y su eje y perpendicularmente al plano lamelar, pero las cadenas pueden rotar a lo largo de su mayor eje, se dice que están en una fase hexagonal. El empacamiento puede ser más cerrado a distancias de <0.41µm de manera que no pueden rotar a lo largo de su eje mayor y con distancia desiguales entre ejes x/y se dice que es una fase ortorómbica, La última es la fase de menor permeabilidad y corresponde al mayor grado estanco de la piel. Los ácidos grasos libres de cadena larga favorecen este estado[44].
La epidermis nucleada subyacente (50-100µm de espesor) al estrato córneo, también hace reflexionar en lo tocante a suministrar ceramidas en formulaciones cutáneas. Es bien conocida la facultad que tiene las ceramidas en desplazar el colesterol de los microdominios lipídicos de las membranas plasmáticas.
La tendencia natural de los fosfolípidos y de los esfingolípidos a formar membranas en bi-estratos, conduce a crear membranas con separación de fases: una cristalina líquida y desordenada compuesta por fosfolípidos y otra sólida gelificada y altamente ordenada a cargo de esfinfolípidos. Esto es debido a que los hidrocarburos aciles de los fosfolípidos son fluidos y desordenados, mientras que las de los esfingolípidos tienden a empacarse en forma cerrada y gelificar. Cuando se le agrega colesterol a la combinación, se forma una fase líquida ordenada y la cual estabiliza a la membrana. Se conservan así las ventajas de la fase gelificada pero sin perder fluidez y se adquieren ciertas ventajas como, entre otras, lo son la movilidad lateral y la elasticidad[45]. Esta habilidad de estabilizar el empacamiento de fosfolípidos y esfingolípidos, no es de tipo quiral: tanto el colesterol enantiómero como el colesterol natural funcionan igual. Simplemente el efecto se debe a su estructura absoluta. La estabilización se observa tanto para esfingolípidos como para fosfolípidos, pero es más acentuada respecto de los esfingolípidos. Por ello se ha hablado en la literatura, de especificidad entre ambos. Por tanto el colesterol resulta ser imprescindible en determinar las características físicas de las membranas y sus microdominios lipídicos. Se alinea con la normal (perpendicularmente) de la membrana pero conservando una libertad de inclinación de 5° (elasticidad) y fija la permeabilidad según su concentración y la temperatura. Dado lo anterior, es natural que alteraciones del contenido de colesterol en las células ocasionen perturbaciones en estos dominios[46].
La preferencia por los esfingolípidos es debida a un apareamiento entre la especie nitrogenada del cabezal del esfingolípido (de naturaleza fosfolipídica) por los oxígenos del colesterol, además de interacciones hidrofóbicas, electrostáticas y fuerzas bipolares de van der Waals. A pesar de tener una estructura semejante las esfingomielinas y los fosfolípidos, estos ligámenes se ejercitan más débilmente por los últimos, de manera que la diferencia se refleja en un ordenamiento más pronunciado del colesterol respecto de las esfingomielinas y tiende a prevalecer tal asociación[47].
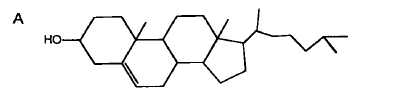
Colesterol Posición del colesterol en el estrato bi-lipídico
Ahora bien, se establece otro tipo de competición entre las ceramidas y el colesterol en lo tocante a ocupar aquellos espacios que se forman entre los hidrocarburos aciles de las efingomielinas creados por la contigüidad de sus cabezales de mayor tamaño, en tanto se acomodan perpendicularmente en las 2 hojuelas del bi-estrato. Las primeras poseen cabezales polares de reducido tamaño y muy cortos para envolver a sus espinas dorsales hidrofóbicas y darles reparo del contacto con los medios acuosos. Por eso para evitar dicho contacto, impulsados termodinámicamente, se escudan bajo el cobijo de la “sombrilla” establecida por el más ancho espacio que los cabezales de las esfingomielinas dejan, cuando un cabezal se coloca a la par del cabezal de la siguiente esfingomielina. Pero ambos lípidos polares no pueden coexistir en un mismo ambiente y tienen que competir para granjearse el ordenamiento que tales dominios reparan. Las ceramidas parecen llevar una leve ventaja al respecto, de manera que excluyen al colesterol cuando hay aumento de las ceramidas en la membrana plasmática.
Más frecuentemente esto sucede por degradación de las esfingomielinas a cargo de la enzima esfingomielinasa (SMase). Hay múltiples estudios que demuestran el desplazamiento del colesterol y sus consecuencias. A grandes rasgos una pérdida de 25% de SM conduce a una pérdida de un 50% de colesterol[48]. Dada la importancia del colesterol en determinar las características físicas de las membranas del estrato nucleado de la epidermis, a todas luces es preferible proveer de colesterol exógeno a la piel que no las ceramidas, tal y como la hace el SEDACTIL.
Se justifica lo anterior para garantizar el empacamineto cerrado que requieren las lamelas del estrato córneo para el efecto de barrera y limitar la pérdida de agua transcutánea. Las unidades lamelares que se repiten cada 130 Ǻ no necesitan la fluidez de la membrana plasmática y el empacamiento de los lípidos es de tipo gel, lo cual se mantiene aún en exceso de colesterol y sin variantes del intervalo de repetición de 130Ǻ entre 20° y 70° C y pH 5-6. Entre más apretado el empacamiento más se limita el movimiento de agua entre la estructura multiestratificada lamelar que envuelve a los corneocitos. En resumen, en el estrato córneo no precisa de la elasticidad y movilidad lateral del bi-estrato fosolipídico. El ordenamiento tipo gel de los lípidos en las lamelas le confieren al estrato córneo impermeabilidad sea horizontalmente que perpendicularmente, para lo cual el empacamiento apretado descrito es importante y es tolerante de exceso de colesterol[49]. Por tanto, SEDACTIL es un excelente protector de la barrera cutánea, tanto por sus componentes no fisiológicos como por los fisiológicos. La tolerancia que existe en suministrar colesterol como precursor por un lado y como integrante del estrato córneo por el otro, garantizan la seguridad del producto.
Aspectos más directamente relacionados con inmunidad tópica
En contraste, en la epidermis nucleada existen diferentes proporciones entre fofolípidos, colesterol y esfingolípidos dependiendo de la localización en la célula y de la membrana, sea esta la plasmática, del retículo endoplásmico, aparato Golgi o trans-Golgi, endosomas y endosomas tardíos, lisosomas y mitocondrial; o del microdominio lipídico (lipid rafts, véase Fig )[50].
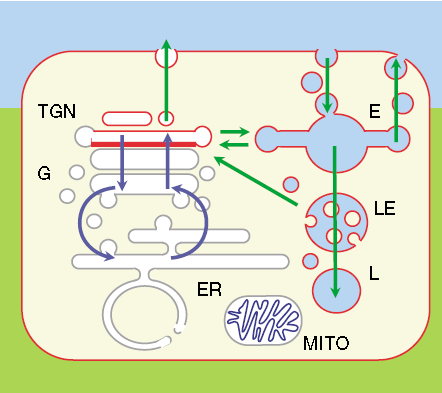
Fig. Organización lipídica en una célula animal.
Todas las membranas celulares están en contacto bidireccional entre ellas mediante tráfico bidireccional, a excepción de las mitocondriales (MITO) y peroxisomas. El retículo endoplásmico (ER) y el aparato de Golgi (G) contiene casi exclusivamente glícerofosoflípidos (color gris). El trasn-Golgi (TGN) los endosomas (E) contienen >10% esfingolípidos y 30-40% colesterol (color rojo). Las vesículas endosómicas tardías (LE) y los lisosomas (L) contienen un lípido único, el ácido lisofosfatídico que se produce localmente y en las MITO la cardiolipina también producida localmente. Las MITO y peroxisomas tienen membranas polares muy parecidas a las del ER (Matsuo et al. 2004)[51]
De la figura es posible notar un marcado gradiente entre los esfingolípidos, el colesterol y los glícerofosfolípidos en la interfaz TGN ― Golgi. El TGN y las organelas endocíticas están enriquecidas >10 veces en esfingolípidos y colesterol respecto del Golgi y el ER.
El colesterol se concentra conforme se sube en el nivel del sendero secretor, desde el sitio de su síntesis al aparto de Golgi y luego hacia la membrana plasmática[52]. Esto es debido a restricciones en el movimiento de los glícerofosfolípidos y esfingolípidos que no se difunden entre las hojuelas de las membranas bi-estratificadas y se produce su enriquecimiento en la hojuela luminal donde se producen. De manera que se dificulta su difusión de la hojuela luminal a la citoplasmática en el Golgi para los glícerofosfolípidos y en la hojuela luminal para los esfingolípidos en el TGN.
Mientras que el colesterol se difunde libremente pero con afinidad por los esfingolípidos; estructura entre las cuales se acomoda fácilmente estereoquímicamente. A 37⁰ C la esfingomielina forma un gel de fase sólida y que al ingresar el colesterol entre las cadenas aciles se produce una transición a la fase líquida ordenada. Muy importante es como veremos, la presencia de colesterol en el aparato endocítico tal como arriba se describe.
A groso modo existe la siguiente segregación en el lumen del Golgi: esfingolípidos/colesterol en los portadores apicales, fosfatidilcolina/colesterol en el transporte basolateral y fosfatidilcolina en el transporte retrogrado. Destaca siempre la importancia del colesterol en configurar estos aparatos celulares y el proceso de la transciosis.
La piel como órgano inmunitario
Es de crucial importancia que los estratos bilipídicos de las células de la piel estén conformados de acuerdo a su normo-tipo, de manera que sus funciones de barrera inmunológica se conserven. Con su composición y funciones plenas y operantes, el órgano está bien dotado para salvaguardar su balance con la microbiota, excluyendo el ingreso de patógenos a los estratos de la epidermis donde pueden ser causa de trastornos patológicos. Un órgano reforzado en sus funciones, puede entonces defenderse sobradamente sin tener que recurrir a eliminar bacterias o virus artificialmente; lo logra simplemente en función de sus atributos como órgano inmunitario y de la composición de su barrera. Tal aparato le confiere a la piel la capacidad de desplegar un sistema defensa completo, que abarca a los queratinocitos, las células de Langerhans (LCs=células dendríticas inmaduras), las células del aparato inmune innato y adquirido, y le permite encarar su exposición perenne al ambiente, la microbiota y los elementos,
Desde la década de los 80 se viene acumulando evidencia sobre el hecho de que la piel funciona como un órgano inmunitario y que funge de suyo como tal. En el 2006 Sugita et al., recopila buena parte de la información que se había publicado al respecto y agrega observaciones apasionantes sobre la participación de los queratinocitos en montar la defensa de la epidermis. No solamente, también aporta evidencia que ilustra como el aparato inmune adquirido epidérmico puede ser activado a partir del reconocimiento inicial que hace el aparato innato de la microbiota y su consecuente estimulación. Esta incesante interacción entre hospedero y microbiota, está fundamentalmente diseñada para proteger al hospedero. La respuesta atenuada que suelen ejercitar las LCs al entrar en contacto con los lipopolisacáridos y al estimularse los receptores TLRs (toll-like), despierta una respuesta inmunitaria innata moderada y se evita la respuesta desbordante e innecesaria que puede dañar al hospedero, como suele suceder con las células dendríticas en otros territorios del organismo humano. De manera que la reacción epidérmica a la microbiota es para tolerar a los comensales y es de naturaleza benéfica. Las LCs están predispuestas a responder en forma menos violenta de cuanto lo hacen las células dendríticas comunes.
Como se señala en el párrafo anterior, los queratinocitos juegan un papel importante como célula productora de citocinas, pero también por su cruda predominancia de especie mayoritaria en las células que componen la epidermis y son fundamentales en cuanto a mantener la homeostasis de la barrera cutánea y en preservar el balance entre señalización pro y antiinflamatoria. El queratinocito basal activado, parece tener artibutos pluripotenciales en lo relativo a sintetizar y secretar citocinas. No solamente es también capaz de sintetizar complemento y especialmente el fragmento C3a[53].
Entre la multitud de citocinas que se sintetizan en la epidermis resalta la abundancia de la Il-1α e Il-1β. Muchos han discutido sobre la presencia de esta citocina pro-inflamatoria en la epidermis y el significado de su abundancia y sus efectos. También se preguntan si su presencia es una situación normal o si es debida al estímulo de la continuada exposición que tiene la piel con la microbiota[54]. Se conoce que en ausencia de estimulación bacteriana la epidermis manifiesta altas tasas de producción de Il-1α, en preferencia a la Il-1β y expresa numerosos receptores para las Il-1s. Igualmente in vitro, queratinocitos cultivados producen la Il-1α, aún en ausencia de una estimulación intencional. Los receptores responden en forma autócrina a las Il-1s y producen ¨citocinas secundarias¨; rasgo muy peculiar de los queratinocitos[55]. Lo cierto es que la epidermis está perfectamente dotada para responder con un perfil Th1, en caso que así lo requiera. Independientemente de cómo llega la Il-1β a ser liberada en la epidermis (vide infra), su contribución en la defensa de las células eucariotas es muy importante debido a que ratones con defectos genéticos en montar respuestas activas con base en la Il-1β, manifiestan una grave suceptibilidad a ser invadidas intracelularmente por bacterias como la Shigella flexneri y Francisella tularensis[56][57],.
Igualmente esta defensa está contrabalanceada por antagonistas, que los mismos queratinocitos producen, y propician un equilibrio, pro y antiinflmatorio, en la piel. Se trata del antagonista del receptor Il-1ra y el receptor Il-1R tipo 2, no activo en la transducción y que se desprende del fragmento extracelular del receptor en la superficie celular para liberarse como un factor soluble. En el microambiente cutáneo, el fragmento liberado en solución muestra acción inhibitoria sobre ambas Il-1α e Il-1β y no interfiere con la acción del Il-1ra, ni con las Il-1 sistémicas. Esto explica la solvencia con que la piel se libra diariamente mediante el despliegue de sus armas tópicas, de una plétora de posibles acercamientos contaminantes y como a duras penas lo advierte el organismo; ya que no se produce secuelas[58].
Como el queratinocito es una célula sésil las citocinas deben viajar desde las células residentes como los macrófagos, las LCs, los mastocitos, los melanocitos, las células de Merkel y los queratinocitos per se, los cuales pueden producirlas constitutivamente, hacia aquel. La respuesta de estas células epidérmicas/dérmicas residentes constituyen parte del aparto inmune tópico. Al entrar la piel en contacto con una plétora de sustancias contaminantes, constituye la primera línea de defensa. Estas sustancias contaminantes pueden consistir en subproductos de paredes bacterianas, de motores flagelares, de ácidos nucléicos bacterianos o modificados del hospedero, moléculas inductoras de stress o de ¨señal de peligro¨ que hacen contacto tanto sobre la superficie celular, como con los endosomas o con el citosol. En los macrófagos fundamentalmente se dispara la transducción celular que converge hacia el núcleo y mediante la transcripción de genes, culmina en la síntesis y secreción del factor de necrosis tumoral TNFα, el cual busca exteriorizarse. Desde el aparato de Golgi viaja hasta la superficie celular en endosomas recicladores, donde por proteólisis a cargo de la enzima convertidora (TACE) es convertido a su estado activo. El arrastre citocínico hacia la superficie está íntimamente relacionado con el proceso de montar una respuesta inmunitaria válida y el proceso de la fagocitosis. Lo anterior porque el endosoma reciclador se fusiona con la membrana precisamente en el lugar de formación de la copa fagocitaria. Durante la fagocitosis hay exceso de membrana bi-lipídica, necesaria tanto para operar la fagocitosis como para la exocitosis del TNFα.
Lo anterior representa una encrucijada que determina la eliminación o la tolerancia de los patógenos, sea para las células fagocitarias profesionales como para las no fagocitarias. Entre las últimas s e encuentran los queratinocitos que en forma perenne encaran a la microbiota y hasta a una serie de patógenos importantes, como el Staphilococcus aureus. Pese a esa exposición, raramente se establece una infección en la piel, gracias al poder constitutivo del queratinocito en eliminarlos (vide infra). En tratar de eliminar a los microorganismos invasores o presentarlos como antígenos al sistema inmunitario adaptativo, las últimas pueden recurrir al interesante mecanismo de la ¨macroautofagia¨ como frontera última del sistema inmunitario innato. Esta realidad es muy compleja, en cuanto que depende de múltiples factores si un patógeno es eliminado luego de ser fagocitado o si prevalece intracelularmente, para sobrevivir tolerado por el hospedero. Esta supervivencia puede ser en un entorno fagosómico o fuera de él; el invasor escapa de la envoltura bi-lipídica para liberarse en el citosol. Esta faceta y argumento, escapa al alcance de este documento y remitimos a los interesados a las apasionantes citas bibliográficas[59],[60],[61].
Atañe al tema de este documento, el hecho que el proceso es sensitivo y dependiente del colesterol. El colesterol es importante sea para la exocitosis del TNFα que para la fagocitosis. Pero en consideración que una buena barrera debe de limitarse a las medidas que le cierran las puertas al invasor antes de que sea necesario fagocitarlos, en este documento se abordará la materia que versa sobre la defensa tópica de la piel y que es posible montar mediante citocinas y defensinas producidas principalmente por las células residentes. Precisamente es el efecto a obtener con un producto como el SEDACTIL.
Desde ese punto de vista, el evento primario en la defensa de la piel en estado de agresión, es la liberación de la Il-1α, ya pre-existente, como vimos anteriormente, por su elaboración constitutiva en el queratinocito. Sin embargo esta liberación de la citocina no es por exocitosis como sucede para el TNFα, sino por derramamiento extracelular a través de una brecha en la membrana plasmática como consecuencia de la agresión; o es decir, por daño celular o por formación de poros en la membrana plasmática. La Il-1α liberada estimula a los KCs vecinos a ulterior producción de Il-1α amplificando la respuesta citocínica. También estimula la secreción de Il-8, Il-6 y el factor estimulante de colonias de granulocitos/monocitos GM-CSF, lo que activa a las células pro-inflamatorias. En particular es esencial la acción de la Il-8 que atrae a los neutrófilos, macrófagos y células T al sitio de daño celular. Los neutrófilos son el arma celular de primera línea que la piel usa por excelencia, cuando se pierde continuidad de la membrana plasmática e inicia el daño celular. Las LCs y los macrófagos constituyen la via contingente para resolver el problema. Son los elementos qur pueden invocar al aparato inmune adaptativo, si se ven obligadas a presentarle los antígenos involucrados en el evento a las células T, mediante complejos MHC. Como bien es conocido, eso induce a la producción de anticuerpos específicos.
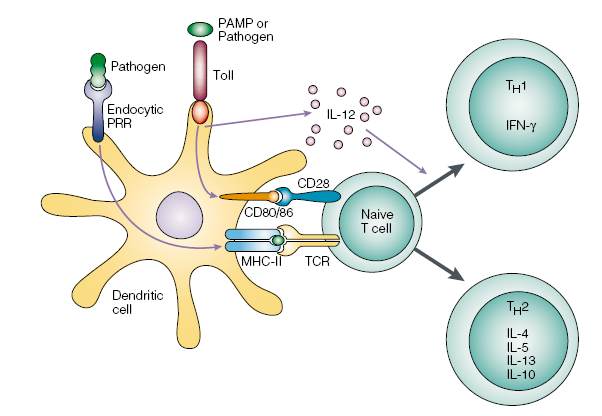
Fig. TLRs e inmunidad adaptativa. El reconocimiento que hacen los TLRs puede expresarse sobre células presentadoras de anticuerpos, como las células dendríticas, lo cual refuerza la expresión de los
co-estimuladores CD80 y CD 86 y el complejo mayor de histocompatibilidad clase II (MHCII). También se estimula la secreción de Il-12 y algunas quimiocinas y sus receptores. La activación de los co-estimuladores conduce la entrada en escena de las células T específicas hacia los patógenos que desencadenaron la acción de los TLRs. La Il-12 conduce a la activación de células T ayudantes Th1 efectoras y a la producción de IFNγ.
No obstante es preferible que el organismo resuelva el evento mediante el uso de inmunidad tópica, por ser un arma limpia, antiinflamatoria y resolutoria, que no deja secuelas; al contrario de la adaptativa. La salvaguarda de la barrera incluye acciones que conjuran y expían una amenaza en el umbral, si el trastorno es despejado mediante la utilización de péptidos catiónicos antimicrobianos producidos por los mismos KCs, como las defensinas y protectinas, intermediarios reactivos de nitrógeno, los péptidos antimicrobianos RNase7 y LL37, derivado el último de las catelicidinas hCAP18 y las antileucoproteasa ALP. La liberación de estas sustancias antimicrobianas por parte de los queratinocitos son inducidas por acción del TNF-α, la IL-1β y la Il-6,[62],[63]. En el caso de los KCs al hacer contacto físico con el Staphilococcus aureus y sin opsonización de la bacteria, en modelos de cultivo ex vivo, eliminan a las bacterias mediante la secreción primordialmente de la HBD3 (beta defensina humana 3) sin necesidad de internalizar la bacteria 1 hr después del contacto[64]. Las proteínas antimicrobianas alcanzar la superficie de la epidermia al ser co-empaquetadas con los lípidos del SC, en los cuerpos lamelares. Por su pronta respuesta y simplicidad, es la defensa ideal en mantener la barrera despejada y sin duda el mecanismo a emular en productos capaces de mantener a los patógenos bajo control en la piel.
Se suman a las sustancias producidas por los KCs aquellas que se liberan de los gránulos específicos de los neutrófilos: la lipocaina NGAL y la catelicidina hCAP18 y de los gránulos primarios (azurofílicos), las α defensinas. Las sustancias antimicrobianas de origen leucocitario se generan en la fase mielocítica/metamielocítica de la hemopoyesis, las primeras, y en la promielocítica, la segunda. De manera que los gránulos azurofílicos representan una fase tardía de defensa y la α defensina se libera en su estado inactivo. Una vez agotado el contenido los gránulos, estos no pueden generar más sustancias antibacterianas a menos que acudan al foco infeccioso nuevos elementos frescos desde la médula. Desde luego le queda al neutrófilo la opción de la fagocitosis; siendo célula fagocitaria de gran valor. Atestigua a la importancia de estos mecanismos, la notable resistencia innata de la epidermis hacia las infecciones gram negativas. Es indicación de la validez de la primera línea de respuesta a contactos hostiles con los receptores de la inmunidad tópica: los receptores “Toll.like” TRL, los cuales después de identificar al invasor emprenden la señalización de defensa (véase pag 27, 28).
A la Il-1α que proviene de los queratinocitos se suma la Il-1α que secretan los macrófagos y las LCs. Estas células tiene mecanismos específicos para sintetizar, madurar y secretar las forma activa de la familia de las Il-1.
Aún después de haberse activado la Il-1α, queda mucha tela por cortar antes de que se agote la barrera tópica. Esto es especialmente atractivo en la epidermis, toda vez que la estimulación paracrina de la Il-1α sobre los KCs vecinos, conduce a la secreción de ulterior de TNFα y citocinas secundarias, amplificando la respuesta y convirtiendo a la zona entre los vasos sanguíneos de la dermis y la epidermis, en una verdadera roca fuerte. Vemos que el queratinocito es un verdadero baluarte en la secreción auto-intracrina y paracrina, En el estado de activación, tiene capacidad de remozar la defensa inmunitaria tópica basada en la secreción de antimicrobianos, posibilidad que le está negada al neutrófilo. Además el remozamiento e insistencia a base de Il-1α, lo habilita a producir ácido araquidónico y a estimular la formación de los eicosanoides, precursores de las prostaglandinas E2 y leucotrieno B4 (LTB4). El TNFβ estimula la formación del ácido hidroxieicosatetratonico (HETE). El leucotrieno LTB4 y el HETE, son ligandos naturales del receptor PPARα y γ, respectivamente, el cual regula el metabolismo de lípidos y lipoproteínas, la proliferación, diferenciación y apoptosis de varios tipos de células incluyendo los sebocitos.
Eje directo entre queratinocitos y señalización resolutoria de la inflamación.
En ese ámbito no solamente pueden resolverse ágilmente los problemas contaminantes, aprovechando lo mejor posible el estímulo original desencadenado por el derramamiento de la Il-1α, sino que también crea el eje de la señalización que conduce a restablecer la homeostasis. (vide infra pag, 24)

La liberación de ácido araquidónico ocurre por acción directa de las fosfolipasasA2 sobre los fosfolípidos de la membrana plasmática. El acoplamiento funcional entre fosfolipasas A2 y las enzimas COX y mediante estímulo de un agonista, conduce a la síntesis de las prostaglandinas. El acoplamiento entre cPLA y COX-1 induce la producción inmediata de prostaglandinas, mientras que el acoplamiento con la COX-2 lo hace en forma tardía[65].
La existencia en la piel de una vía directa (eje) hacia la ¨resolución¨ desde etapas muy tempranas, posibilita una salida limpia y es muy esclarecedor. Esto también explica y justifica el uso de POLYACTIL-N gel y PETROACTIL en resolver los problemas del acné. Los resultados en este trastorno con los productos citados, son impresionantes y resolutivos. De estos resultados que se observan, se infiere que los productos son capaces de señalizar la correcta resolución de la inflamación –además de la evidencia acumulada en la resolución de heridas crónicas– y que el eje se encarga de sintetizar los lípidos que se ocupan normalmente de señalizar los eventos resolutivos. Valen siempre en el acné valen los otros mecanismos que se invocan en las páginas n° 11,12 y 13.
La roca fuerte Epidermis/Dermis
 Fig Ilustra la zona que funciona como roca fuerte de la inmunidad tópica y los puntos de encuentro entre inmunidad tópica y adaptativa. La inmunidad adaptativa puede entrar en juego, o por presentación de antígenos o por reclutamiento de células T con memoria, células dendríticas inmaduras estimuladas por las β defensinas, los péptidos antimicrobianos o la quimicina CCR6.
Fig Ilustra la zona que funciona como roca fuerte de la inmunidad tópica y los puntos de encuentro entre inmunidad tópica y adaptativa. La inmunidad adaptativa puede entrar en juego, o por presentación de antígenos o por reclutamiento de células T con memoria, células dendríticas inmaduras estimuladas por las β defensinas, los péptidos antimicrobianos o la quimicina CCR6.
Barrera citocínica
Aún cuando la barrera anatómica y la matriz extracelular (ECM) hayan sufrido un daño mayor pero que es manejable por cuenta de la acción de los queratinocitos y los neutrófilos, el proceso está lejos del punto de no retorno, o quizás, en un retorno que demanda pagar un precio. La defensa de primera línea que componen los queratinocitos y neutrófilos es válida. Puede arriesgar aventurarse en la zona gris de la inflamación y acercarse al punto de encuentro con la inmunidad adaptativa, pero con opción clara de retorno hacia la resolución del proceso.
El compromiso más avanzado que demanda la participación de ulteriores elementos celulares atraídos al foco infeccioso por las citocinas, puede dar manifestaciones clínicas y ser, de desde casi imperceptible, hasta comprometer áreas importantes de epidermis con signos cardinales de inflamación o una serie de sus matices. La inflamación más grave, pone en juego eventos de mayor complejidad, no bien reconocidos y comprendidos hasta la fecha. Hay un punto de encuentro entre la defensa innata y adaptativa desde el cual el retorno es fácil. Si el punto de encuentro es rebasado, por la gravedad o rebeldía de la inflamación, se dificulta el dar marcha atrás y el retorno puede implicar tener que dejar estigmas (fibrosis), o puede persistir un proceso inflamatorio de fondo que no se extingue (herida crónica o inflamación crónica).
Resolución de la inflamación
Las dificultades en restituir la homeostasis radican en que el fenómeno inverso, es decir la resolución de la inflamación, apenas comienza a ser dilucidada y que no poseemos armas terapéuticas bien logradas para estimular su feliz terminación. Esto significa que si se puso en marcha la inflamación, para hacerla desparecer no basta con atenuarla y sentirnos seguros porque no percibimos más los síntomas. Sino que el proceso debe de resolverse por entero y debe de ser restablecida la homesotasis en los tejidos que sufrieron el ataque. Como en todo otro órgano, la inflamación en la piel es una enfermedad y esta tiene sus fases de inicio, auge y resolución. Conocemos muy bien la primera 1era, más o menos la 2da, pero desconocemos de la señalización y mecanismos que la resuelven y menos los trastornos que pueden originarse en caso de que falle su terminación. Lo anotado es muy afín a la cicatrización; si se causó daño a las células y a la ECM durante el ataque. No solamente –y visto el problema del lado positivo– siempre y cuando la señalización emane del proceso resolutivo donde se encuentran la defensa innata y la adaptativa, la reparación y el retorno a la homeostasis es regenerativo.

El tema requeriría de amplio espacio para abordarlo, pero se dirá solamente que es necesario destacar algunos aspectos sobre los cuales podemos tener injerencia si conocemos mejor los mecanismos que los gobiernan. Estos se relacionan con el amplio uso que se ha hecho de los inhibidores de la COX2 y el hecho que actúan justamente donde se da el punto de encuentro, pero negativamente. Fundamentalmente hay una serie de compuestos moleculares que modulan la acción de los TLR y los NODs en la activación de la defensa innata. Así como estos receptores necesitan ser activados para que la Il-1α pase del estado a reposo a su estado activo, los mismos receptores necesitan ser regulados oportunamente para que se produzca la terminación del proceso. Lo anterior es especialmente necesario cuando fueron reclutados elementos celulares al foco infeccioso que pertenecen al brazo del adaptativo de la inmunidad. La señalización en esta fase está dirigida para que tales células salgan –por sus propios medios– del foco infeccioso a la circulación linfática, o para que entren en apoptosis y luego sean fagocitadas por los macrófagos, Es mandatorio que se complete el proceso de limpieza y reparación. Los mediadores de la resolución son productos de degradación de la ECM que emanan del tejido inflamado. Las células del estroma que detectan la degradación, mandan señales para: i) el cese de la señalización inflamatoria, ii) la normalización de los gradientes de las citocinas y quimiocinas, iii) activar programas de señalización que inducen la apoptosis de las células que fueron reclutadas o su salida por la circulación linfática[66]. A estas alturas como puede apreciarse, el retorno es un evento más complejo.
RECEPTORES DE LA INMUNIDAD TÓPICA
El problema con los inhibidores de la COX2 es que inhiben justamente a los mediadores que se producen durante esta crucial fase de resolución; cuando lo que se requiere es más bien su estimulación. Las prostaglandinas E2 y G2 juegan un papel importante tanto en iniciar la inflamación como en estimular la resolución según incidencias témporo-espaciales. Por ejemplo: deficiencias en prostaglandinas pueden ser subsanadas por sustitutos epiméricos de éstas y que se estimulan por la ingesta de la aspirina, como son las lipoxinas. También mediante la ingesta de ácidos grasos libres ω-3, se generan sustitutos epiméricos de las prostaglandinas tales como las resolvinas y protectinas, útiles en inducir la resolución de la inflamación[67]. No obstante, no queda claro cómo y cuándo utilizarlos, a pesar de su uso tan difundido, y queda por aterrizar sin ambigüedades los parámetros clínicos que señalan la fase de evolución en que se encuentra el proceso inflamatorio y las medidas a usar para inducir su clara resolución.
En el documento se ha hecho referencia los TRLs. Estos receptores hacen parte de varios otros componentes del sistema que reconoce bacterias, hongos, micobacterias, DNA y RNA virus y ptotozoarios. A diferencia del sistema inmunitario adaptativo que se base sobre millones de reccptores que actúan en la superficie de los linfocitos y que específicamente reconocen una amplia variedad de antígenos, el sistema tópico se basa sobre la acción no específica de unos pocos receptores que tiene la aptitud de reconocer patrones moleculares asociados a patógenos. Por esa razón se les llama receptores reconocedores de patrones, PRRs y las moléculas asociadas a los patógenos son vitales para su supervivencia (poseen codificación germinal) y variar su composición sería catastrófico para el patógeno. Estos son los patrones moleculares asociados a patógenos o PAMPs que incluyen a los ácidos nucléicos virales, los componentes de la pared celular bacteriana y micótica (lipopolisacáridos LPS y péptidoglicanos PGNs, las proteícas flagelares y sujetos a ser potenciados por una serie de alertas de peligro que emana de las mismas células del hospedero. También el sistema reconoce a sus propios tejidos de manera que existe la posibilidad de ser activado por las mismas moléculas del hospedero. No obstante el sistema está rigurosamente balanceado para evitar activación de inflamación aberrante y activar problemas autoinmunes. Patrones de defensa que se fundamentan sobre la inmunidad tópica, responderán invariablemente al ataque de los patógenos y si se quiere, con vigor renovado, visto que mediante la incursión a llamar en escena la inmunidad adaptativa, puede adquirir memoria (véase pag 22).
The specificity of TLR recognition for several important PAMPs has been identified, including recognition of peptidoglycan (PGN), bacterial lipoproteins, and zymosan by TLR2; double-stranded RNA by TLR3; lipopolysaccharide (LPS) and heat-shock proteins (HSPs) by TLR4; flagellin by TLR5; and CpG motifs of bacterial DNA by TLR9 [5 ]. A multitude of studies have reported additional microbial ligands for TLRs, as summarized in other reviews [2 , 5 ]. In addition, an increasing number of reports suggest recognition of endogenous ligands such as HSPs, fibronectin, and hyaluronic acid oligosaccharides by TLRs and modulation of autoimmune processes
La activación induce a la movilización de sustancias moleculares efectoras de defensa que son solubles y que pueden eliminar los invasores que se encuentran en los tejidos infectados o en células invadidas, la inducción de funciones especializadas en las células residentes centinela, la síntesis de moléculas co-estimuladoras a cargo de las células presentadoras de antígeno, y a la erradicación in extremis del ataque, optando por recurrir a la inmunidad adaptativa y otras respuestas fisiológicas. El proceso conduce a la activación de algunos genes por transcripción que estimulan el factor nuclear κB (FN-κB) o el gene IFN que estimula la producción de interferónβ (IFNβ), que movilizan a los efectores de la inflamación y de supervivencia celular.
Existen 3 tipos de receptores, los TLRs que son proteínas transmembranosas que se activan por medio de ligandos extracelulares que se acomodan en un dominio de unidades que se repiten y son ricos en leucinas. Estas apuntan al ambiente extracelular o también sus dominios TIR y TRIF vigilan hacia el lumen de los endosomas y fagosomas intracelulares y donde pueden detectar ácidos nucléicos microbianos.

Fig Sensores en la membrana plasmática
Las otras dos familias de receptores son solubles y están localizados en el citoplasma y son los receptores NOD-like (NLRs) y las helicasas gen de ácido retinoico inducible RIGs que gobierna la formación de la familia de receptore RIGlike (RLRs). De esta familia, el RIG-1 es el sensor más importante de infecciones virales en las células que no son dendríticas estimulando la producción de los interferones tipo I. Los NLRs respoden principlamente a los PGNs y estimulan la síntesis de las IL1s.

Fig Sensores bacterianos en el citoplasma y secreción de Il-1α
Los ligandos de los sistemas RLRs y NLRs son a menudo compartidos con el sistema TLRs, a pesar de que las interacciones en el complejo receptor/ligando difieren, como también sus efectos. Entre los 3 sistemas existe además una interacción a nivel de las cascadas intracelulares, que les permite montar respuestas inmunes con sinergismo y concurrentes. En caso de infecciones virales los TLR3, TLR7, TLR8 y TLR9 no localizados sobre la superficie celular, pueden traficar entre el ER y los endosomas y los autofagosomas.

Fig Esquema de los 3 sistemas TLR, RLR,NLR y CLR, ligandos y sus interacciones y el cometido final que es la secreción de Il-1β
Más tardíamente la secreción de Interferon α y β
Una cuarta categoría está a cargo de la familia de los receptores tipo lectina C, que incluyen un receptor de la manosa, de la molécula de adhesión intercelular 3 (ICAM-3) específica de las células dendríticas, dectina 1 y 2 y colectinas, los cuales reconocen a los hongos y producen la señalización para su eliminación por fagocitosis o mediante modulación de la respuesta inmune del hospedero[68].
Para comprende mejor el tema sobre los receptores de la inmunidad tópica, es necesario establecer cómo se establece una respuesta diferente dependiendo de la vía que el patógeno trata de utilizar para invadir al hospedero. Arriba se puede encontrar la respuesta que se evoca mediante el acercamiento del patógeno a los TLRs, la cual se da preferentemente desde el ámbito pericelular y la estimulación de los TLRs a nivel de la membrana plasmática. Pero para estimular a los NLRs que tiene localización citoplasmática, es claro que para activar los receptores, debió haberse producido cierto grado de penetración o de perforación de la membrana. Indistintamente de cómo haga esto el patógeno, el sendero de los TLRs sigue una vía diferente de activación la cual involucra la activación de la caspasa-1 ruta que implica una plétora de opciones distintas.
Modelo que representa los senderos inflamatorios de la inmunidad tópica activados por bacterias patógenas y el papel de la caspasa-12 en inhibir la caspasa-1. La vía TLR es mediante el NF-κB. La vía NRL es mediante la caspasa-1
Fig .
Estudios genéticos han demostrado que existe un polimorfismo nucleotídico Las caspasas a las que se refiere el esquema representado, son inflamatorias. Ahora bien la caspasa-12 ilustra muy bien la importancia de montar respuestas inflamatorias adecuadas.
singular (SNP) por el cual el gen de la caspasa-12 muestra en su exón 4 un componente CARD truncado, que por un codón stop prematuro que expresa la proteína incompleta en la mayoría de la población. Sin embargo un 20% de la población africana o descendientes de ellos, contiene una arginina adicional por no poseer el stop codón. Los genes en estos sujetos leen la secuencia completa y sintetizan la caspasa en su forma completa y al sintetizar la proenzima más potente, abaten intensamente su respuesta inflamatoria. En consecuencia, son altamente susceptibles a las endotoxinas y sufren sepsis severas. Rastreos de la divulgación del gene truncado demuestran que el stop codón originó en Africa hace unos 100.000 años. Inicialmente el polimorfismo era neutro, pero alrededor de 60.000 años atrás, sucesivamente a la migración de Africa a Europa y Asia, debido a una mayor exposición al frío e infecciones a que los migrantes se vieron expuestos, una selección positiva forzó el polimorfismo a fijarse en su posición. Por tanto el gene trunco de la caspasa-12 se considera que confiere resistencia a la sepsis y es la mejor demostración de la expresión in vivo del polimorfismo y lo difícil que es en humanos vaticinar el desenlace ante un ataque lanzado por microorganismos patógenos.
Pero a la altura de tener que confrontar a los patógenos en el citosol, la célula está expuesta otro tipo de batalla. Es decir, atrás quedaron las defensas arriba descritas y la célula debe de tomar decisiones graves en protección el organismo multicelular superior del cual hace parte. Esta decisión puede involucrar la señalización de la muerte misma de la célula como medida extrema en pos de coronar la destrucción del patógeno. La comprobación de estas realidades han cambiado la forma de ver la relación hospedero/patógeno, en vista de que tales medidas, a primera vista desesperadas, a menudo pueden beneficiar al hospedero; pero también pueden beneficiar al patógeno en su cometido de establecerse y replicarse en los tejidos del hospedero.
Sea cual fuere el desenlace, es merecedor de notar que cuando la única salida es la muerte celular, el objeto de inmolación trata por todos los medios de salir de escena sin derramar el citosol al ambiente extracelular. Cuando el citosol entra en contacto con la ECM se exacerba la respuesta inflamatoria, evento que es perjudicial para el hospedero. La opción forma aún parte de la relación patógeno/hospedero y es deseable que la célula coopere en la contienda extrema contra el patógeno, en salir de escena ordenadamente sin dejar secuelas.
El argumento es muy reciente y escapa al alcance del documento y es mediado por toda una familia de caspasa que conducen a la muerte celular. Sin embargo se expondrá en forma esquemática, las 4 formas de muerte celular que existen y se proporcionará la cita bibliográfica para los interesados que deseen profundizar sobre el tema. Se hace mención
Fig Muerte cellular inducida por patógenos. Todas muestran características diferentes, si bien algunas de ellas son compartidas. La apoptosis y autofagia no desatan inflamación, derrame de citocinas o contenido citoplasmático. La oncosis y la piroptosis permiten el derrame del contenido citoplasmático, evento altamente inflamatorio. Sin embargo la piroptosis ocurre rápidamente y con carga microbiana no tan severa, de manera que in vivo el efecto puede ser mitigado debido a que el fenómeno es mediado por la caspasa-1. Hay otros eventos pro-inflamatorios que la caspasa-1 estimula y además hay substratos accesorios de la caspasa-1 que perdura aún cuando haya deficiencia de caspasa-1 y contribuyen a la defensa; como en ratones KO de capasa-1 que son resistentes a la endotoxemia y al shock séptico. De manera que la piroptosis puede ser beneficiosa para el hospedero. Como se aprecia, durante la apoptosis los patógenos son englobados en envolturas apoptóticas y digeridos por fagolisosomas. Durante la autofagia, los patógenos son englobados en autofagosomas y digeridos por autofagolisosomas. La oncosis decididamente favorece al patógeno.
también sobre de la aptitud de los KCs en internalizar y fagocitar al Stapilococcus aureus como parte del sistema innato inmunitario cuando el patógeno penetra hacia los estratos nucleados de la epidermis (véase cita n 64).
Pero no siempre la activación de los receptores intracelulares conduce a la muerte celular. Incluso no queda claro si en vez de producirse activación de esos receptores, que la célula más bien detecta el peligro por la disrupción de la membrana que se produce y, que según el daño, responde por el sendero NALP o por el de IPAF (véase fig ). Una respuesta conduciría a la muerte celular y la otra a la reparación de la membrana y al aumento de la supervivencia celular. La eventualidad de supervivencia, depende forzosamente de la membrana y de su integridad. Si la integridad necesita ser restituida, se gesta mediante la activación de las proteína esterol regulatorias (SREBPs), las cuales favorecen la reparación de la membrana. Las SREBPs activan directamente más de 30 genes dedicados a la síntesis de colesterol, ácidos grasos y triglicéridos, como también el co-factor NADPH que provee la energía para la tarea[69],[70]. No solamente, la estimulación de las SREBPs, caspasa-1 dependientes, incrementan la supervivencia celular cuando el daño de la membrana consiste en poros creados por las toxinas del patógeno, con el fin de inyectarlas en el citosol[71],[72]. La importancia de la membrana celular en la relación entre patógenos y hospedero, queda muy bien ejemplificada por estos hallazgos. Se comprende mejor también la importancia de los lípidos en fungir como sustratos y elementos de señalización en la importante tarea de mantener la eficacia de la barrera que establece el deslinde entre medio ambiente y el ser vivo.
Igualmente se comprende mejor el papel que juegan los lípidos de la membrana a partir de ácidos grasos poli-insaturados de 20 carbonos (ácido araquidónico: contenido en los fosfolípidos) y que metabolizados a sus varios derivados, eicosanoides y prostaglandinas, fungen como mediadores en la resolución de la inflamación y la cicatrización regenerativa.
Por último, en muy importante notar que todo el aparto de señalización TLR se organiza en microdominios lipídicos de la membrana plasmática y los cuales son ricos en colesterol, de manera que se destaca nuevamente la importancia de los lípidos en organizar la defensa tópica hacia agentes patógenos. Estudios de la difusión lateral en los microdominios lipídicos antes y después de ser estimulados por LPS, demuestran que los receptores demuestran disminución en su coeficiente de difusión lateral después de la estimulación, lo que identifica la localización del receptor en el microdominio[73].
Para los interesados en profundizar sobre los temas, se recomienda leer:
Host Innate Immune Receptors and Beyond: Making Sense of Microbial Infections
Ken J. Ishii, Shohei Koyama, Atsushi Nakagawa, Cevayir Coban, and Shizuo Akira Cell Host & Microbe 3, pag 352-364 June 2008.
Cell death in the host response to infection
K Labbe´ and M Saleh Cell Death and Differentiation (2008) 15, 1339–1349
Characterization of human glutathione-dependent microsomal prostaglandin E synthase-1
Staffan Thorén 2003 ISBN: 91-7349- 637-5
DEFENSA TÓPICA AL SERVICIO DE PIEL SANA Y LIBRE DE PATÓGENOS
Uno se pregunta si es posible sacarle partido a la defensa tópica de la piel para que el órgano las aproveche al máximo y se emancipe en relacionarse con la microbiota. No se necesitaría recurrir a maniobras que merman la integridad de la barrera al intentar esterilizarla (¡lo que es un absurdo!). Pero si se logra fortalecerla, por sus propios medios mantendrá más que integridad y estará libre de patógenos.
Como se expuso en las secciones anteriores, existe suficiente respuesta inmunitaria de tipo tópico en la piel para lograr ese cometido. El hecho es que en la última década ha surgido interés por desarrollar nuevos tipos de vacunas. No obstante la vacuna basada en la inmunidad tópica no ha transcendido del laboratorio o a lo sumo en estudios clínicos fase I. La dificultad radica en la toxicidad de los agonistas que se ha empleado en desarrollarlas y los efectos adversos que se suscitan. Estos incluyen, ciertas sales minerales derivadas del aluminio, citocinas inmunoestimuladoras, partículas de lípidos, microparticulados y los así llamados coadyuvantes mucosos. También existe el problema que ninguno de los agonistas es capaz de provocar por sí solo una respuesta válida y que la mayoría funcionan como coadyuvantes.
Antes de conocer de que es posible suscitar resistencia inespecífica in vivo al ataque de bacterias gran-negativas y virus de influenza con previa exposición de 24 hrs de los receptores agonistas (monofosforil lípido A)[74] de LPS o al LPS mismo, se sabía que ratones C3H/HeJ con deficiencias en el TLR4 que los hace responder débilmente a los LPS, mueren con dosis mucho menores después de la exposición al ligando, que en ratones normales. Se estudiaron modelos con exposición a Escherichia coli[75], Neisseria meningitidis[76] y Francisella tularenssis[77].
Al estudiar el efecto de la exposición de estos ratones a los tóxicos bacterianos se pudo constatar que son debidos a la estimulación del receptor TLR4 y que pueden notarse entre minutos y horas después de haberse producido la estimulación, pero que también existen efectos a más largo plazo que son imputables a la entrada en juego de la inmunidad adaptativa según el tenor de estimulación citocínica que se logró impulsar como respuesta al ataque microbiano. Es conveniente el estudio in vivo de esos efectos, para entender la naturaleza del mecanismo de protección y los factores que contribuyen a su puesta en marcha. Adicionalmente al sendero de inmediata señalización, MyD88 dependiente, luego de la ligazón del agonista con los receptores TLR3 y 4 –y el cual tipifica a la inmunidad tópica– la cascada puede seguir la ruta de señalización TRIF (MyD88 independiente) y que resulta en la expresión del factor regulador de interferón 3 y eventualmente en la más tardía producción de interferón α y β; solamente detectable a partir de 24hrs de la estimulación del receptor.
Parecen sumarse in vivo una combinación cautelosa de múltiples mecanismos pertenecientes a ambos sistemas inmunitarios. El cuadro serológico a partir de la estimulación nos muestra la elevación de numerosas coticinas y quimiocinas inflamatorias, TNF-α, Il-6. RANTES (quimiocina quimiotática CCL5), proteína inducible iIFN-10, la sintasa de óxido nítrico inducible iNOS, la proteína inflamatoria de macrófagos-1 y la expresión de células asesinas naturales NK, macrófagos, células dendríticas y células B. Mientras que, como arriba se dijo, la producción de IFN no es detectable hasta las 24 hrs después de la suministración intravenosa o intranasal del LPS o de una sustancia LPS-símil agonista[78]. Es interesante que la defensa antiviral se produce aún cuando el ligando del receptor no es de tipo viral
Eventualmente se ha logrado caracterizar in vivo no solamente la protección que la estimulación de los receptores de la inmunidad innata montan al ser estimulados por toxinas o agonistas, sino el papel que juegan las varias cascadas de señalización y las moléculas adaptadoras y los efectos que se observan en modelos experimentales de ratones KO de tales mecanismos. Las moléculas adaptadoras MyD88 e IRAK4 son esenciales en completar la señalización proinflamatoria en virtualmente la entera gamas de TLRs. Ratones MyD88–/– son altamente susceptibles a infecciones por Staphylococcus aureus, Listeria monocytogenes, Mycobacterium avium y parásitos como Toxoplasma gondii, Leishmania major y el nematodo intestinal Trichuris muris a pesar de que la capacidad fagocitaria de las células inmunitarias quedó intacta. No hay datos disponibles del comportamiento de ratones MyD88–/– ante microorganismos gran-negativos. En infecciones por Mycobacterium tuberculosis y priones la respuesta es MyD88–/– independiente.
Los ratones IRAK–/– son deficitarios en producción de citocinas y resistentes al shock endotóxico, pero altamente susceptibles a la infección por S. aureus a infección por virus de coriomeningitis linfocítica, por deficiente producción de IFN-γ.
La existencia de los ratones mutantes con defectos TLR4 ha refundido el estudio de esta deficiencia al ataque que experimentalmente sufren estos ejemplares. Las observaciones arriba consignadas, se ampliaron más recientemente a la susceptibilidad que tienen contra el establecimiento de neumonía por Haemophilus influenza y S. pneumoniae, sepsis por Klebsiella pneumoniae, peritonitis por Salmonella. Lo mismo en cuanto a la defensa contra Aspergillus fumigatus y Candida albicans. La defensa de estos ratones contra M. tuberculosis está apenas marginalmente comprometida y no hay involucramiento del TLR4 en la infección experimental contra Legionella pneumoniae o virus influenza. No obstante los ratones tienen defensas comprometidas contra el virus sincicial, por insuficiencia de secreción de Il-12 y en la función de células naturales asesinas NK. Fundamentalmente los ratones KO tienen un reclutamiento disminuido de neutrófilos al sitio de infección por insuficiente producción de citocinas, quimicinas y expresión de sus receptores[79].
En cuanto a la falta del TLR2, es el receptor más importante en infecciones por bacterias Gram-positivas y que detecta el ácido lipoteicoico y los péptidoglicanos, por tanto es de presumir que ratones TLR2–/– son altamente susceptibles a infección por S.aureus, Streptococcus pneumoniae, M. tuberculosis o bovis. Mas los mecanismos de protección son poco claros y difieren según la bacteria que entre en contacto con los ratones TLR2–/–. Estas diferencias se atribuyen a la deficiente estimulación citocínica que manifiestan en su susceptibilidad a S.aureus y M. tuberculosis, mientras que a niveles desmedidos de inflamación (a pesar de niveles de citocinas comparables) en las infecciones por neumococos.
De manera que existe evidencia abrumadora que justifica el desarrollar nuevos métodos de estimulación de la defensa tópica en la piel. No obstante no se ha trascendido de la fase experimental en ratones. Pero con base en la observación que en la superficie de las células de Langerhans existen altos niveles de ATPasa (CD39), es razonable presumir su susceptibilidad al ATP y de que puede constituir un óptimo puesto para estimular la inmunidad tópica. No solamente, parece ser que todo el perfil citocínico de los queratinocitos y de las células residentes en la piel que gira en torno a la Il-1β, está basado también en su sensibilidad al ATP. La asombrosa habilidad del nucleótido en estimular la liberación masiva de Il-1β de fagocitos y otras células cebadas con LPS refuerzan la presunción. Incluso la liberación in vitro de Il-1β en monocitos activados es muy poco eficiente y solamente se logra detectar un 10% de la citocina producida extracelularmente. El problema es más pronunciado en los queratinocitos, donde la liberación es por derrame como anteriormente fue referido. Este hallazgo ha hecho pensar que la liberación de la citocina se da por 2 estímulos: el primero que activa el gen y la acumulación de la forma inactiva, la pro-Il-1 y el segundo que la procesa y la libera[80]. Existe por tanto una amplio acopio de utilización de esta citocina tan importante.
Además en años recientes se ha constatado la importancia del ATP extracelular como generador de señales de peligro que denuncian daño celular local y como disparador de la inflamación. Sus atributos para dicha tarea son: alta concentración intra/extracelular y el amplio margen de utilización, hidrofilia, expresión ubicua de sistemas de degradación muy eficientes (ATPasas), presencia de receptores específicos bien diferenciados y fuerte poder para madurar las células dendríticas[81]. La maduración y liberación de la Il-1β está mediada por el receptor purinérgico específico para el ATP extracelular, receptor P2X7 [82]. La presencia de citocina inflamatorias y sustancias microbianas aumentan la sensibilidad del receptor P2X7 al ATP[83].
Adicionalmente a sus funciones vitales metabólicas que desempeña el ATP a nivel sub-celular, se han identificado otros atributos como molécula señalizadora en funciones variadas, como la proliferación celular, diferenciación, muerte celular, quimiotaxis en diferentes tejidos de elementos de origen hematopoyético o acción sobre los mismas células hemáticas[84]. De manera que la estimulación de la vía purinérgica puede implicar desenlaces favorables dependiendo de la suma de diferentes estímulos y su contra-balance en el terreno donde se ejerce la señalización.
No obstante ante la complejidad del sistema inmune tópico (véase fig ) y las múltiples formas de detección de patógenos, con lagunas que todavía existen en completar la caracterización del sistema y la colaboración que existe entre los diferentes mecanismos de detección y la respuesta final que se expresa, no se puede anticipar el efecto final que obtendrá al tratar de obtener la estimulación de la vía pro-inflamatoria. Como se ha expuesto y se muestra en la fig. ésta conduce a la síntesis, acumulación, secreción o derrame de citocinas y en especial la Il-1β. Pero como adicionalmente se aprecia, para lograr ese cometido se involucra a la caspasa-1 y como la señalización proviene de cascadas que tienen distintos orígenes el resultado también puede variar y abrirnos las puertas a resultados muy gratificantes, tal como se insinúa en el párrafo anterior.
La estimulación purinérgica de los receptores P2XR por inyección intradérmica con agonistas ATPγS en ratones BALB/c resulta en un aumento inmediato de la hipersensibilidad por contacto y de la sensibilidad diferida tipo Arthus, lo que confirma la inmunoestimulación por la vía purinérgica[85].
Hay 3 aspectos del producto que
- Reconstituyente de la barrera física
Esta función resulta clara al leer la primera parte del documento, donde se expone la composición de los productos POLYACTIL-N gel y PETROACTIL. El tema que atañe a la incorporación en estos productos de los lípidos no fisiológicos y las razones que sustentan la escogencia, aplica a SEDACTIL. De manera que como primera función el producto reconstituye el estrato córneo y lo mantiene de óptima hidratación. - Citoprotección de la barrera nucleada
Hasta el momento los productos para uso dermatológico han hecho poco usos del colesterol como ingrediente clave de la formulación y como precursor para estimular el aparato hormonal tópico. En el documento se tratará el tema de la citoprotección y se refiere al anexo el tema de las posibilidades de estimular a partir de la Dehidroandorsterona la gama de hormonas que la piel elabora localmente.
El especialmente útil usar el colesteron en la piel, debido a que además de ser un ingrediente clave de las lamelas intercelulares en el estrato córneo, no existe peligro de usarlo para la citoprotección del estrato nucleado, en cuanto que el aporte exógeno de colesterol libre no representa peligro en desequilibrar la homeoviscosidad de la membrana plasmática de las células del estrato basal, espinoso y granular ni del contenido total de la célula. Primero está la preponderancia de colesterol no esterificado en estas células en la membrana plasmática que ronda alrededor de un 65/80% y la regulación del colesterol total de la célula a partir de la actividad química del colesterol libre en los estratos bi-lipídicos.
La señalización se activa en el momento que el colesterol está presente en exceso sobre los fosfolípidos de la membrana. Puede suceder también en caso de que haya desplazamiento de colesterol por exceso de ceramidas, por adquir actividad química al desvincularse de los fosfolípidos. En el caso de desvinculación por simple exceso de la esfingomielina, la alta actividad química de colesterol libre en las hojuelas de la membrana plasmática se encarga de busca una vía de salida. En los queratinocitos esta vía es natural, hacia el estrato córneo y el medio ambiente, sin la ayuda de lipoproteínas; como sucede en el eflujo del colesterol en células de cara a otros microambientes del organismo. En la epidermis la colesterol oxidasa degrada el exceso por un lado, o, el excedente contribuye a la formación de microdominios lipídicos que la curvatura de la membrana facilita, reforzando asimismo la inmunidad tópica de las células nucleadas por el otro. En el aspecto de retroalimentación que emana desde la membrana para la síntesis del colesterol en el retículo endoplasmático –según el estado de homeoviscosidad en que se encuentre– no existe peligro de inhibición y más bien se estimula la redistribución del colesterol celular. La hojuela exoplasmática de la vertiente apical de los epitelios columnados polarizados (como en el caso de la epidermis) es prioritaria en la redistribución. Las señales que recibe el aparto productor de sintetizar poca cantidad y de operar reposadamente, permiten concentrar el énfasis sobre esos lugares críticos. Entonces tampoco le sale sobrando a la hojuela exoplasmática de la membrana el colesterol exógeno, en vista de la alta concentración de colesterol no esterificado (35/40% de los lípidos de la membrana) que debe mantener. Por tanto, no existe peligro de suministrar exceso de colesterol en la piel; contrariamente a lo que sucede con las ceramidas. De todos modos la concentración de colesterol que contiene el SEDACTIL, es muy equilibrada.
Otra razón que justifica el colesterol como ingrediente clave del SEDACTIL se relaciona con el mecanismo de reabastecimiento desde el lugar de su síntesis en el ER, hasta completar su tránsito a la membrana plasmática. El colesterol fluye intracelularmente y no primordialmente usando organelas vesiculares. Mas el colesterol que contienen las vesículas de exocitosis en su membrana, puede llegar a la membrana plasmática cuando se completa cada ciclo de transcitosis, Las organelas se fusionan con la membrana plasmática en el acto de entregar su contenido fuera de la célula. Debido a su cola acil hidrofóbica de 8 carbonos, el colesterol en ese momento puede fluir libremente entre bi-estratos lipídicos, sin asistencia de proteínas. Pero la mayor fracción del colesterol fluye intracelularmente desde el ER sin unirse a vesículas, en un tiempo½ de 10-20 min[86]. En vista del intervalo que media, tanto en la transitosis como en el tránsito no vesicular, la libre disponibilidad de colesterol exógeno inmediato puede mejorar la estabilidad de membrana.
Los múltiples efectos del colesterol sobre la membrana plasmática son: 1) estabilizante 2) reduce la permeabilidad a iones (cationes en especial) y sustancias polares de bajo peso molecular 3) facilita la interacción entre células 4) influye sobre las transiciones de fase (ordena las membranas que se encuentran en la fase líquida) 5) establece un microambiente propicio para asociar a las proteínas transmembranosas y se liga químicamente, como requisito, a proteínas transportadoras 6) aumenta el grosor de la membrana de 25.8 Ǻ a 29.9 Ǻ 7) esencial para integridad estructural de caveolae, microdominios lipídicos y la comunicación mediante las uniones basales 8) funge como anti-oxidante junto con α-tocoferol. - Estimulación de la inmunidad tópica y señalizador resolutivo
Esta función también queda clara de las secciones sobre tema arriba expuestas. No obstante la vinculación del producto en cuanto a los integrantes que pueden estimular los receptores purinérgicos, queda reservada al momento en que se publique la patente que también arriba se cita.
No obstante la pruebas prácticas de la resolución inflamatoria y su natural epílogo de evolucionar a la cicatrización regenerativa, fueron claramente demostrados según la evidencia arriba presentada.
En suma, el sencillo uso de SEDACTIL produce en el usuario fuerte impresión subjetiva de los avances que este nuevo enfoque aporta a la dermatología y de que el producto efectivamente se adhiere a los principios preconizados.
Por las razones apuntadas el SEDACTIL suministra los precursores básicos para la lipidogénesis, los cuales son el colesterol y ácidos grasos seleccionados: ácido C18 esteárico y C16 palmítico. No contiene ceramidas que se sintetizan a partir de ácidos grasos y por tanto no son substratos, además por los peligros que implica su uso en desplazar el colesterol de las membranas y de inducir la diferenciación queratinocítica prematuramente. (Véase fig ).
Los 3 productos 1) POLYACTIL-N gel, 2) PETROACTIL y 3) SEDACTIL ofrecen un enfoque integral en la práctica dermatológica y da la oportunidad de escoger 3 opciones según el grado de evolución de la lesión. También hay posibilidades de combinar los productos en casos especiales o seguir la secuencia según el orden en que fueron citados en este párrafo

Fig. Muestra la síntesis de las lamelas extracelulares a partir de sus precursores
USOS ESPECÍFICOS
Introducción
–.Piel expuesta a los elementos (vide infra)
Si se mide el daño que sufre la piel durante la exposición a los elementos en términos del perfil citocínico, salta a relucir un desequilibrio entre la relación Il.1α y Il-1ra a favor de la primera, lo que establece su carácter inflamatorio. Lo anterior se acentúa en la cara donde el perfil inflamatorio prevalece en sujetos normales y especialmente porque en esta zona la piel es más delgada (menos de la media de 15 estratos de corneocitos) y manifiesta un recambio acelerado del SC que dura 7 días solamente.
En tales circunstancias se pueden usar los productos en mención desde quemaduras por exposición UVB, frío o por rayos x usando el 1 y 2. El SEDACTIL o el 3, es excelente para la piel expuesta en grado menor y sobremanera en la cara Este producto no necesita de filtros UV.
Piel seca y dermatitis atópica
Si bien se han hecho comparaciones entre piel seca y dermatitis atópica en cuanto al trastorno que ambos trastornos producen en el SC primordialmente, existe una diferencia fundamental del punto de vista de la recuperación de la barrera cuando se decide su tratamiento. En piel seca la recuperación de la barrera con SEDACTIL es extraordinariamente, buena a pesar de que se delega la recuperación de la pérdida de ceramida 1 con ácidos grasos ω para que sea sintetizada en forma natural por la misma piel. Mientras que en dermatitis la atópica, a pesar de que la pérdida de ceramida está causada por un defecto enzimático, se combinan factores genéticos[87], desregulación del sistema inmunitario, una barrera epidérmica defectuosa y factores ambientales. De manera que el enfoque en SEDACTIL está dirigido a ejercer un efecto antiinflamatorio sobre perfil Th 2 (un 70-80% de los pacientes lo manifiestan y son sensibles a los alérgenos y se correlaciona con la severidad=atopia extrínseca) y antialérgico/neuroendócrino gobernado por mastocitos sin que medie degranulación alérgica y defectos en autoregulación de células intraepidérmicas γδT, más que por corrección directa del defecto en la concentración de ceramidas. Cuando se comparan estos 2 factores etiológicos experimentalmente en ratones IL18 ‾/‾ BALB, es posible determinar que lo más importante en este trastorno es inhibir la secreción de la Il-18 y las quimiocinas producidas por los KCs. Estos ratones sin capacidad de producir la Il-18 resisten al ataque de la SpA (poteína A) del S. aureus y a destrucción de la barrera por aplicación de 4% SDS (sodio dilauril sulfato) en 5cm2 de piel del dorso diariamente. De manera que el beneficio más importante en dermatitis atópica no es por restitución de los lípidos del SC; y aquí también la tarea se delega a la recuperación por síntesis natural de los KCs. Este enfoque deja sobrante el intento de disminuir la muy temida colonización de S. aureus, típica del padecimiento y se enfila a atacar el problema de desregulación inflamatoria, delegando el control bacteriano sobre la eficiencia de la inmunidad tópica. Otro beneficio muy importante que se observa con SEDACTIL, es en el alivio del prurito.
También es importante destacar respecto del trastorno inmunitario tipo Th2, la relación que existe entre dermatitis atópica y asma, toda vez que un 50% de los pacientes con DA desarrolla asma[88]. Dentro de la investigación y desarrollo del grupo de productos que se exponen en este documento, existe también el control del asma mediante la señalización purinérgica por vía transdérmica. Si bien la nueva metódica se encuentra en su fase final de desarrollo y no está en el mercado, cabe puntualizar que está establecido que también se enfoca sobre los aspectos de control de la desregulación inflamatoria arriba señalados y no en los polimorfismos genéticos con resultados excelentes registrados.
Otros factores de complejidad de la DA, como la sensibilización a las levaduras Malassezia y en especial a la Malassezia sympodialis solamente pueden ser corregidos con el aborde descrito en vista de que entra en escena una hiperreacción alérgica IgE y de células T en contra de la levadura y sus alérgenos.
Estos datos apoyan fuertemente el aborde de los productos en mención, los cuales están dirigidos a los factores etiopatogenéticos cruciales poderados dejando como secundario la restitución de ceramidas.
Del punto de vista de la protección en la piel afectada, está la interesantísima innovación del SEDACTIL en formar especialmente en las manos, un ¨guante inivisible¨ que persiste por horas.y es inclusive resistente a 1 y 2 lavadas, dependiendo de la entereza de la lavada. En otras partes, la protección dura por el día entero hasta que no proceda de nuevo a bañarse. Esto significa que si se utiliza el SEDACTIL a primera hora en la mañana después de bañarse, el sujeto puede proceder a sus labores regularmente sin peligro de que sustancias irritantes agraven su condición y por otro lado, sin que contamine los alimentos o materiales que manipule y, en el caso especial del personal de salud, sin contaminar a los pacientes.
Dermatitis seborreica
Este trastorno se relaciona con cuero cabelludo seco y la caspa. En fin de cuentas es una manifestación severa de la caspa y puede manifestarse en la cara, el pecho y la espalda; además del cuero cabelludo. Convergen 3 factores en su etiología: 1) secreción sebácea aumentada 2) metabolismo de la microflora 3) susceptibilidad individual. De los tres, el menos dilucidado –si bien la sospecha existió por más de un siglo– es la presencia de las 10 diferentes especies de levaduras Malassezia en la piel y cuero cabelludo y las lipasas que expresan. Esta presencia y el papel que juegan en la etiología de la dermatitis seborreica, ha sido recientemente establecida por métodos moleculares. Las Malassezia más comunes en el cuero cabelludo son: la M restricta y M globosa. La última es la que produce mayor cantidad de lipasa. Estas levaduras se adaptan a vivir en el cuero cabelludo de los individuos suceptibles y productores de exceso de sebo, el cual degradan y liberan los ácidos grasos de los triglicéridos, para luego consumirlos. Consumen los ácidos grasos saturados y dejan atrás los insaturados, alterando el balance de la composición de sebo que se vuelve irritativo estimulando la producción de descamación. Experimentalmente ha sido demostrado que si se remueven los microorganismos con champús anticaspa, la composición del sebo recupera su normalidad y mejora la descamación[89]. Las manifestaciones más avanzadas son las dermatíticas que se extienden a otros territorios aledaños y que pueden presentar inflamación de mediana a severa intensidad.
Para estas manifestaciones más severas es ideal el uso de POLYACTIL-N gel. La estimulación purinérgica combate la Malassezia y refuerza la inmunidad tópica. Es interesante al respecto que la incidencia mayor y las manifestaciones más severas de la dermatitis seborreica, se observan en individuos inmunocomprometidos. Estos sujetos tiene deficiencia de catelicidina LL-37 y son susceptibles a superinfeciones que producen eleczema herpeticum[90].Además el hidrogel que carece de lípidos, es particularmente apto para combatir las manifestaciones más severas. Dominado el problema inflamatorio pueden tener uso restringido, los productos 2 y 3, según la producción de sebo del individuo y su propensión a responder vigorosamente al sebo alterado.
Rosácea
Este trastorno parece mostrar la cara opuesta en cuanto a la expresión de proteínas antimicrobianas de la inmunidad innata. Como se dijo acerca de la dermatitis atópica y la deficiencia en la LL-37, en rosácea más bien existe una expresión exagerada de esta proteína antimicrobiana. Las catelicidinas son producidas como propéptidos inactivos que son activados por protreasa-serinas y en este caso: la enzima tríptica del estrato córneo (SCTE) o kalicreina-5. Según este enfoque muy reciente (2005) los otros efectos no antibacterianos de la LL-37, explicarían los fenómenos vasculares que son muy notorios y carácterísticos, como el eritema facial y las teleangectasias. También es relevante notar que entre esos efectos está también la angiogénesis y la elevada expresi{on de factor de crecimiento endotelial en pacientes con rosácea. Lo que aclara mucho esta parte de la patogenia y que anteriormente se explicaba por mecanismos vasoactivos gatillados por elastosis actínica en la dermis de individuos de piel blanca muy sensible que conducirían a edema e inflamación. En pacientes con rosácea es posible cuantificar niveles x10 veces de lo normal de LL-37 y x1000 veces de lo normal de SCTE, en el pliegue naso-malar de sujetos enfermos, lo que parece resolver el argumento a favor del tema inmunitario.
No obstante la presunta participación de otros factores infeccioso/parasitarios y pilosebáceos en el trastorno, y la imposibilidad de unificar todos los factores etiológicos de la afección en una teoría patogénica única, hacer dudar del origen rigurosamente genético de la rosácea y de sospechar la co-participación infecciosa en activar la gran expresión de catelicidina y en generar las respuestas inmunológicas de hipersensibilidad retardada que se han relacionado con el ácaro Demodex folliculorum en el cuadro granulomatoso de rosácea.
Estudios histopatológicos de los folículos tienden a incriminar al folículo como fuente de los problemas inflamatorios o de las reacciones inmunitarias específicas arriba señaladas, a partir de la obstrucción mecánica del poro folicular producida por el Demodex folliculorum o de bacterias de las cuales el ácaro es vector. Un nuevo estudio del 2007 publicado en el Britsh Journal of Deramatology, los investigadores identificaron mediante una prueba de proliferación de células mononucleares en la sangre periférica una respuesta inmune a la bacteria Bacillus oleronius –específicamente asociada al Demodex– en un 79% de 22 sujetos con rosácea pápulo-pustular y un 29% de 17 sujetos sin el trastorno[91]. Esto es reminiscente de la etiopatogenia del acné. Los sujetos, y en especial los que presentan el cuadro pápulo-pustular, responden positivamente a las terapias de antibióticos tópicos y orales dirigidas al acné y al control del Propionibacterium acnés. Visto el éxito en controlar el acné con el producto 1 y 2, se propone el uso del mismo esquema arriba detallado, para los casos de rosácea.
En caso de una futura verificación concluyente sobre la asociación de rosácea con infecciones gástricas de Helicobacter pylori, como se ha inferido en varios estudios, existen productos en desarrollo relacionados con los que mencionan este documento, los cuales podrían ser utilizados en controlar ese aspecto.
Dermatitis alérgica y dermatitis irritante por contacto
Pese a su distinta patogenia, estas 2 entidades tienen similitud impresionante respecto de su manifestación clínica, histología e inmunohistología. No hay diferencia en cuanto a su manejo, de manera que es preferible tratarlas como una sola entidad. En laa mayoría de los casos se puede usar el SEDACTIL para ek control de estos problemas, pero en casos más severos con formación de vesículas o escamas, puede iniciarse con el 1 y 2. Si el sujeto debe de estar permanentemente en contacto con el irritante, es interesante que el uso metódico de SEDACTIL antes de llevar a cabo su labor (véase dermatitis atópica), le protege de la irritación.
Esto significa que el ¨guante invisible¨ protege al sujeto del renovado contacto con el alergeno o el irritante, posibilidad que no tiene precedentes y supera a todos los otros métodos y en especial a los guantes semipermeables[92]: El ¨guante invisible¨ da completa libertad de uso, visto y considerado que a pesar de que el usuario siente la protección, tiene total libertad de manos sin vestir objetos que ulteriormente pueden hasta agravarle la condición El SEDACTIL es específico para ser usado en situaciones en que es deseable prevenir la acumulación de bacterias patógenas: como en el manejo de alimentos o personal que debe cuidar a pacientes en ambientes hospitalarios o ambulatorios. Este personal debe de usar el producto antes y después de haber sido expuesto a los irritantes o material contaminante. Este método es la antítesis del uso de alcoholes y del lavado de manos llevado in extremis, en esos ambientes[93]. Como se pudo apreciar de las páginas que anteceden, la estimulación de la inmunidad tópica es una verdadera novedad en el manejo de piel irritada. POLYACTIL-N gel, PETROACTIL y SEDACTIL son las innovaciones postrimeras en el cuidado de manos y áreas de piel expuestas a alérgenos e irritantes, toda vez que reconstituyen anatómicamente e inmunitariamente las barreras de la piel.
Piel en edad avanzada
Son notorios los trastornos que manifiestan en la piel los adultos mayores. La piel cronológicamente envejecida mantiene integridad del SC pero con disminución de su capacidad de recuperación, con reducción de los lípidos del SC y del número de lamelas extracelulares. Pero la función de barrera no disminuye y más bien el Sc es un poco más impermeable de lo normal posiblemente debido a un mayor espesor y achatamiento de los corneocitos que maduran más lentamente. De manera que la inflamación a tarda edad es más por cambios de fisuras que resultan por hábito de rascarse, debido a una menor cantidad de aminoácidos hidratantes (NMF factor natural humectante) y reducción del ablandamiento de las lamelas que los aminoácidos inducen al disminuir las fuerzas intermoleculares las moléculas de queratina estructurales. Además existe una disminución en la síntesis de los lípidos y más dramáticamente por lo que concierne la síntesis del colesterol. De manera que las formulaciones que son dominantes colesterol, son especiales para controlar los problemas de piel de los adultos mayores. Es aparente de todo lo expuesto en este documento, como el SEDACTIL puede beneficiar a la piel de los adultos mayores. Véase anexo en lo relativo a producción tópica de androesteroides y beneficio en piel de adultos mayores.
Piel en ambiente frío y caliente
Con mucha frecuencia exposición de la piel a fuerte abuso ambiental como la irradiación los UV rayosX, el calor o congelamiento, produce dermatitis aguda irritante con la formación de vesículas sin que el estrato córneo llegue a ceder y se rompa. Lo que indudablemente indica que el SC es más resistente que la epidermis nucleada viva subyacente. Esto ha sido confirmado experimentalmente y en modelos de SC in vivo y en animales y se ha observado que la pérdida de barrera y de agua en estas lesiones es relativamente tardía y se detecta a partir de las 24hrs. En esencia se trata de una quemadura de 2do grado y el uso combinado de 1 y 2 en ellas es ideal. Se notará que la aplicación tiende a reabsorber el fluido de la vesícula y que el dolor y la inflamación se aplaca. Después de unos días el SC se desprende como piel de cebolla y el proceso evoluciona sin infección, Las lesiones de 1er grado responden con mínima tendencia a escarapelar y el dolor cede rápidamente por varias horas. Luego que se resuelve la inflamación se asconseja usar SEDACTIL para acelerar la reconstitución del SC en forma óptima en vista de que se requieren como 10 días para que se recupere la capacidad de barrera del SC en lesiones de 2do grado y 45 días si se rompe la vesícula. La evolución de estas lesiones con el tratamiento de 1 y 2 y luego SEDACTIL sin que se infecte la lesión es verdaderamente un avance.
Es interesante también estudiar el efecto que tiene la aclimatización en ambientes extremos sobre las membranas plasmáticas de la piel y el partido que se puede sacar del SEDACTIL en ambientes donde puede existir pérdida exagerada de agua epidérmica y la piel se seca causa prurito y puede hasta inflamarse. Estudios en animales ectotérmicos han dilucidado que la epidermis tiende a acumular colesterol en ambos extremos de ambientes. Es más marcado en la epidermis de animales que se han aclimatizado al calor, pero en aquellos aclimatizados a ambientes fríos o no hay cambios en el contenido del colesterol de las membranas plasmáticas o hay un ligero aumento[94]. SEDACTIL ha dado excelentes resultados en individuos que desarrollan piel seca en clima frío, previene la resequedad o también domina el prurito y los cambios inflamatorios.
Herpes simplex y zoster, tinea, levaduras, intertrigo y papilomavirus
Estas infecciones que afectan con cierta frecuencia a la piel, si son vistas de un punto de vista de inmunidad innata, vemos como las defensa tópicas montan con ligero retardo un perfil anti viral y antimicótico según lo expuesto en este documento. Con base en esta eventualidad y la postulación de la señalización purinérgica, se ha observado que los productos 1 y 2, son magníficos agentes en controlar estas afecciones. El SEDACTIL puede ser usado para mantenimiento o para prevenir recurrencias especialmente en pliegues cutáneos.
En el caso del Papilomavirus, se aconseja usarlos cuando las verrugas han sido extirpadas. En primer lugar para obtener una cicatrización óptima y luego para evitar recidivas.
Impétigo
Responde al uso de productos 1 y 2
Queratosis actínica y seborreica
Los productos 1 y 2, son óptimos para usarlos después de haber eliminado quirúrgicamente o por otros medios, cualquier queratosis o tumor. La cicatrzación o la regeneración de defectos de sustancia que puedan resultar, evolucionan magníficamente y en especial cuando hay áreas que necesitan ser cubiertas con regeneración de epitelio.
- Kozono, D. and Agre, P. (2004) From structure to disease: the evolving tale of aquaporin biology. Nat. Rev. Mol. Cell Biol. 5, 687-698 ↑
- Verkman, A. S. (2005) More than just water channels: unexpected cellular roles ofaquaporins. J. Cell Sci. 118, 3225-3232 ↑
- Hara-Chikuma, M. and Verkman, A. S. (2005) Aquaporin-3 functions as a glyceroltransporter in mammalian skin. Biol. Cell 97, 479-486 ↑
- Hara, M., Ma, T. and Verkman, A. S. (2002) Selectively reduced glycerol in skin ofaquaporin-3-deficient mice may account for impaired skin hydration, elasticity, andbarrier recovery. J. Biol. Chem. 277, 46616-46621 ↑
- Hara, M. and Verkman, A. S. (2003) Glycerol replacement corrects defective skinhydration, elasticity, and barrier function in aquaporin-3-deficient mice. Proc. Natl. Acad. Sci. U S A 100, 7360-7365 ↑
- Condeelis, J. (1993). Life at the leading edge: the formation of cell protrusions. Annu. Rev. Cell Biol. 9, 411-444. ↑
- Lauffenburger, D. A. and Horwitz, A. F. (1996). Cell migration: a physically integrated molecular process. Cell 84, 359-369. ↑
- Schwab, A. (2001). Function and spatial distribution of ion channels and transporters in cell migration. Am. J. Physiol. Renal Physiol. 280, F739-F747. ↑
- Verkman, A. S. (2005) More than just water channels: unexpected cellular roles of aquaporins. J. Cell Sci. 118, 3225-3232 ↑
- Oster, G. F. and Perelson, A. S. (1987) The physics of cell motility. J. Cell Sci. Suppl. 8,35-54 ↑
- Pollard, T.D. and Borisy, G.G. (2003) Cellular motility driven by assembly and disassembly of actin filaments. Cell 112:453-65. ↑
- Hara-Chikuma, M. and Verkman, A. S. (2005) Aquaporin-3 functions as a glyceroltransporter in mammalian skin. Biol. Cell 97, 479-486 ↑
- Cong Cao, Yun Sun, Sarah Healey, Zhigang Bi, Gang Hu, Shu Wan, Nicola Kouttab,Wenming Chu, and Yinsheng Wan EGFR-MEDIATED EXPRESSION OF AQUAPORIN-3 IS INVOLVED IN HUMAN SKIN FIBROBLAST MIGRATION Biochemical Journal Immediate Publication. Published on 19 Jul 2006 as manuscript BJ20060816 ↑
- Zelenina, M., Tritto, S., Bondar, A. A., Zelenin, S. and Aperia, A. (2004) Copper inhibits the water and glycerol permeability of aquaporin-3. J. Biol. Chem. 279, 51939 51943 ↑
- Zelenina, M., Bondar, A. A., Zelenin, S. and Aperia, A. (2003) Nickel and extracellular acidification inhibit the water permeability of human aquaporin-3 in lung epithelial cells.J. Biol. Chem. 278, 30037-30043 ↑
- Saadoun, S., Papadopoulos, M. C., Watanabe, H., Yan, D., Manley, G. T. and Verkman, A. S. (2005) Involvement of aquaporin-4 in astroglial cell migration and glial scar formation. J. Cell Sci. 118, 5691-5698 ↑
- Saadoun, S., Papadopoulos, M. C., Hara-Chikuma, M. and Verkman, A. S. (2005)Impairment of angiogenesis and cell migration by targeted aquaporin-1 gene disruption.Nature 434, 786-792 ↑
- Richard C. Kurten, Parag Chowdhury, Ronald C. Sanders, Jr., Laura M. Pittman, Laura W. Sessions, Timothy C. Chambers, Christopher S. Lyle, Bradley J. Schnackenberg, and Stacie M. Jones1, Coordinating epidermal growth factor-induced motility promotes efficient wound closure Am J Physiol Cell Physiol 288: C109–C121, 2005. ↑
- J, Chai, A.S. Tarnawsky. Serum Response Factor: Discovery, Biological Roles and Implications for Tissue Injury Healing Journal of Physiology and Pharmacology 2002, 53. 2, 147-157 ↑
- Bortz JT, Wertz PW, Downing DT. The origin of alkanes found in human skin surface lipids J Invest Dematol. 1990 May, 94(5): 730-1 ↑
- Marilyn A. Lamp, Mary L. Willimas, and Peter M. Elias. Human epidermal lpids, characterization and modulations during differentiation. J Lipid Res. 1983, 24: 131-140. ↑
- F. BontÄ, A. Saunois, P. Pinguet, A. Meybeck. Existence of a lipid gradient in the upper stratum corneum and its possible biological significance Archives of Dermatological Research Vol 289, n⁰ 2/ enero 1997. ↑
- Williams, M.L. and P.M. Elias, 1982. N-Alkanes in normal and pathological human scale. Biochem. Biophys. Res. Commun. 107: 322-328 ↑
- Lester, D.E. 1979, Normal paraffins in living matter occurrence, metabolism and pathology Prog. Food Nutr. Sci. 3:1-66 ↑
- Williams, M. L., S. Grayson, P. M. Elias, J. M. Bonifas,and E. M. Epstein, Jr. 1982. Localization of steroid sulfatase and cholesterol sulfate in normal and x-linked ichthyotic epidermis. Clin. Res. 30: I61A. ↑
- Marilyn A. Lampe, A. L. Burlingame, JoAnne Whitney, Mary L. Williams, Barbara E. Brown,
Esther Roitman, and Peter M. Elias Human stratum corneum lipids: characterization and regional
variations J. Lipid Rus 1983. 24: 120-130. ↑ - Ghadially RG, Halkier-Sorensen L, Elias PM. Effects of petrolatum on stratum corneum structure and function. J Am Acad Dermatol 1992;26:387-96. ↑
- Mao-Qiang M, Brown BE, Wu-Pong S, et al. Exogenous non-physiologic vs. physiologic lipids: divergent mechanisms for correction of permeability barrier dysfunction. Arcn Dermatol 1995; 131:809-16. ↑
- Gudmundur Bergsson Antimicrobial polypeptides and lipids as a part of innate defense mechanism of fish and human fetus Theses Karolinska Institutet Stockholm 2005 ↑
- María Cecilia Orlandi. Piel sana y manto ácido. Folia dermatol. Perú2004; 15 (2): 121-12 ↑
- Yi Zhang, Mingming Xiang, Yun Wang, Jun Yan, Yijun Zeng, Jin Yu and Tian Yang Bulge cells of human hair follicles: segregation, cultivation and properties Colloids and Surfaces B: Biointerfaces Volume 47, Issue 1, 15 January 2006, Pages 50-56 ↑
- Karime Marques Hassun Acne: etiopatogenia An bras Dermatol, Rio de Janeiro, 75(l):7-15,jan./fev. 2000. ↑
- Mao-Qiang M. Brown BE. Wu S. Feingold KR. Elias PM: Exogenous non-physíological vs. physiological lipids: divergent mechanisms for correction of permeability barrier dysfunction. Arch Dennatol 131:809-876. 1995a ↑
- Christopher L. Hedberg, Philip W. Wcrtz, and Donald T. Downing. The time course of lipid synthesis in pig epidermis J Invest Dermatol 91:169-174 1988 ↑
- Feingold KR The role of epidermal lipids in cutaneous permeability barrier homeostasis J. Lipid Res. 2007. 48: 2531–2546. ↑
- Holleran, W. M., K. R. Feingold, M. Q. Man, W. N. Gao, J. M. Lee,and P. M. Elias. 1991. Regulation of epidermal sphingolipid synthesis by permeability barrier function. J. Lipid Res. 32: 1151–1158. ↑
- Ruvolo PP, Ceramide regulates cellular hoemostasis via diverse stress signaling pathways Leukemia (2001) 15, 1153–1160 ↑
- Bose R, Verheij M, Haimovitz-Friedman A, Scotto K, Fuks Z, Kolesnick RN. Ceramide synthetase mediates daunorubicininduced apoptosis: an alternative mechanism for generating death signals. Cell 1995; 82: 405–411. ↑
- Obeid LM, Lindardic CM, Karolak LA, Hannun YA. Programmed cell death induced by ceramide. Science 1993; 259: 1769–1771. ↑
- Tepper CG, Jayadev S, Liu B, Bielawska A, Wolff RA, Yonehara S, Hannun YA, Seldin MF. Role for ceramide as an endogenous mediator ofFas-induced cytotoxicity. Proc Natl Acad Sci USA 1995; 92: 8443–8447. ↑
- Quintans J, Kilkus J, McShan CL, Gottschalk AR, Dawson G. Ceramide mediates the apoptotic response ofWEHI 231 cells to antiimmunoglobulin, corticosteroids and irradiation. Biochem Biophys Res Commun 1994; 202: 710–714. ↑
- Hannun YA, Luberto C. Ceramide in the eukaryotic stress response. Trends Cell Biol 2000; 10: 73–80. ↑
- Jose Antonio Chavez, Trina A. Knotts, Li-Ping Wang, Guibin Li Rick T. Dobrowsky, Gregory L. Florant, and Scott A. Summers A Role for Ceramide, but not Diacylglycerol, in the Antagonism of Insulin Signal Transduction by Saturated Fatty Acids The Jour of Biol Chem Vol. 278, Issue 12, 10297-10303, March 21, 2003 ↑
- Bouswtra JA, Ponec M The skin barrier in healthy and diseased state Biochimica et Biophysica Acta 1758 (2006) 2080–2095 ↑
- Amit Kessel, Nir Ben-Tal, and Sylvio May Interactions of Cholesterol with Lipid Bilayers: The Preferred Configuration and Fluctuations Biophysical Journal Volume 81 August 2001 643–658 ↑
- Linda J. PIKE Lipid rafts: heterogeneity on the high seas Biochem. J. (2004) 378, 281–292 ↑
- Jussi Aittoniemi, Perttu S. Niemela, Marja T. Hyvo nen,y Mikko Karttunen, and Ilpo Vattulainen Insight into the Putative Specific Interactions between Cholesterol, Sphingomyelin, and Palmitoyl-Oleoyl Phosphatidylcholine Biophysical Journal Volume 92 February 2007 1125–1137 ↑
- Megha and Erwin London Ceramides selectively displace colesterol from ordered lipids domains THE JOURNAL OF BIOLOGICAL CHEMISTRY Vol. 279, No. 11, Issue of March 12, pp. 9997–10004, 2004 ↑
- McIntosh TJ Organization of Skin Stratum Corneum Extracellular Lamellae: Diffraction Evidence for Asymmetric Distribution of Cholesterol Biophysical Journal 85:1675-1681 2003↑
- Van Meer G, Cellular lipidomics The EMBO Journal (2005) 24: 3159-3165 ↑
- Matsuo H, Chevallier J, Mayran N, Le Blanc I, Ferguson C, Faure J, Blanc NS, Matile S, Dubochet J, Sadoul R, Parton RG, Vilbois F, Gruenberg J (2004) Role of LBPA and Alix in multivesicular liposome formation and endosome organization. Science 303: 531–534 ↑
- Bretscher, M. S. and S. Munro. 1993. Cholesterol and the Golgi apparatus. Science 261:1280-1281. ↑
- Rahul Purwar, Miriam Wittmann, Jörg Zwirner, Martin Oppermann, Michael Kracht, Oliver Dittrich-Breiholz, Ralf Gutzmer, and Thomas Werfel Induction of C3 and CCL2 by C3a in Keratinocytes: A NovelAutocrine Amplification Loop of Inflammatory Skin Reactions The Journal of Immunology, 2006, 177: 4444–4450. ↑
- C Hauser, JH Saurat, A Schmitt, F Jaunin and JM Dayer Interleukin 1 is present in normal humanEpidermis The Journal of Immunology, Vol 136, Issue 9 3317-3323, 1986 ↑
- Kupper, T. S. 1990. The activated keratinocyte: a model for inducible cytokine production by non-bone marrow-derived cells in cutaneous inflammatory and immune responses. J. Invest. Dermatol. 94:146S–150S. ↑
- Sansonetti, P.J., Phalipon, A., Arondel, J., Thirumalai, K., Banerjee, S., Akira, S., Takeda, K., and Zychlinsky, A. (2000). Caspase-1 activation of IL-1beta and IL-18 are essential for Shigella flexneri-induced inflammation. Immunity 12, 581–590. ↑
- Mariathasan, S., Weiss, D.S., Dixit, V.M., and Monack, D.M. (2005). Innate immunity against Francisella tularensis is dependent on the ASC/caspase-1 axis. J. Exp. Med. 202, 1043–1049 ↑
- TAMARA RAUSCHMAYR, RICHARD W. GROVES, AND THOMAS S. KUPPER Keratinocyte expression of the type 2 interleukin 1 receptormediates local and specific inhibition of interleukin 1-mediated inflammation Proc. Natl. Acad. Sci. USA Vol. 94, pp. 5814–5819, May 1997 ↑
- Nakagawa I. Autophagy as an Innate Defense System against Invading Pathogenic Bacteria J Oral Biosci 47(1) : 11-17 (2005) ↑
- Schmid D, Dengjel J, Schoor O, Stevanovic S, Münz C. Autophagy in innate and adaptive immunity against intracellular pathogens. J Mol Med. 2006 Mar;84(3):194-202. Epub 2006 Jan 28. ↑
- Nakagawa I, Amano A, Mizushima N, Yamamoto A, Yamaguchi H, Kamimoto T, Nara A, Funao J, Nakata M, Tsuda K, Hamada S, Yoshimori T Autophagy defends cells against invading group A Streptococcus. Science. 2004 Nov 5; 306(5698):1037-40.. ↑
- Liu AY, Destoumieux D, Wong AV, et al. Human beta-defensin-2 production in keratinocytes is regulated by interleukin-1, bacteria, and the state of differentiation. J Invest Dermatol 2002; 118(2): 275-81 ↑
- Yang D, Chen Q, Hoover DM, et al. Many chemokines including CCL20/MIP-3alpha display antimicrobial activity. J Leukoc Biol 2003; 74(3): 448-55. ↑
- Kevin O Kisich, Michael D Howell, Mark Boguniewicz, Heather R Heizer, Nori U Watson and Donald Y M LeungThe Constitutive Capacity of Human Keratinocytes to Kill Staphylococcus aureus Is Dependent on β-Defensin 3 Journal of Investigative Dermatology (2007) 127, 2368–2380↑
-
-
- Krystyna E. Rys-Sikora, Raymond L. Konger, John W. Schoggins, Rama Malaviya, and Alice P. Pentland Coordinate expression of secretory phospholipase A2 and cyclooxygenase-2 in activated human keratinocytes Am J Physiol Cell Physiol Vol. 278, Issue 4, C822-C833, April 2000
-
- Charles N. Serhan, Sue D. Brain, Christopher D. Buckley, Derek W. Gilroy,Christopher Haslett, Luke A. J. O’Neill, Mauro Perretti, Adriano G. Rossi,and John L. Wallace Resolution of inflammation: state of the art, definitionsand terms FASEB J. 21, 325–332 (2007) ↑
- Serhan, C. N., Hong, S., Gronert, K., Colgan, S. P., Devchand, P. R., Mirick, G., and Moussignac, R.-L. (2002) Resolvins: a family of bioactive products of omega-3 fatty acid transformation circuits initiated by aspirin treatment that counter proinflammation signals. J. Exp. Med. 196, 1025–1037 ↑
- Willment JA, Brown GD. C-type lectin receptors in antifungal immunity. Trends Microbiol. 2008 Jan;16(1):27-32↑
- Horton, J.D. and I. Shimomura, Sterol regulatory element-binding proteins: activators of cholesterol and fatty acid biosynthesis. Curr Opin Lipidol, 1999. 10(2): p. 143-50. ↑
- Sakakura, Y., et al., Sterol regulatory element-binding proteins induce an entire pathway of cholesterol synthesis. Biochem Biophys Res Commun, 2001. 286(1): p. 176-83. ↑
- Gurcel, L Abrami, S Girardin, J Tschopp, F van der Goot. Caspase-1 Activation of lipid Metabolic Pathways in Response to Bacterial Pore Forming Toxins Promotes Cell Survival.
Cell vol 126 Issue 6, Pages 1135-1145 ↑ - IWAN WALEV,1 EDITH MARTIN, DANIEL JONAS, MANSOUR MOHAMADZADEH,WOLFGANG MULLER-KLIESER, LEONI KUNZ, AND SUCHARIT BHAKDI Staphylococcal Alpha-Toxin Kills Human Keratinocytes by Permeabilizing the Plasma Membrane for Monovalent Ions INFECTION AND IMMUNITY, Dec. 1993, p. 4972-4979 Vol. 61, No. 12 ↑
- Martha Triantafilou, Siegfried Morath, Alan Mackie, Thomas Hartung and Kathy Triantafilou, Lateral diffusion of Toll-like receptors reveals that they are transiently confined within lipidrafts on the plasma membrane Journal of Cell Science 117, 4007-4014 (2004) ↑
- Myers, K. R., A. T. Truchot, J. Ward, Y. Hudson, and J. T. Ulrich. 1990. A critical determinant of lipid A endotoxic activity, p. 145–156. In A. Nowotny, J. J. Spitzer, and E. J. Ziegler (ed.), Cellular and molecular aspects of endotoxin reactions. Elsevier Sciences Publishers B.V., Amsterdam, TheNetherlands. ↑
- Hagberg, L., R. Hull, S. Hull, J. R. McGhee, S. M. Michalek, and C. Svanborg Eden. 1984. Difference in susceptibility to gram-negative urinary tract infection between C3H/HeJ and C3H/HeN mice. Infect. Immun. 46: 839–844. ↑
- Woods, J. P., J. A. Frelinger, G. Warrack, and J. G. Cannon. 1988. Mouse genetic locus Lps influences susceptibility to Neisseria meningitidis infection. Infect. Immun. 56:1950–1955. ↑
- Macela, A., J. Stulik, L. Hernychova, M. Kroca, Z. Krocova, and H. Kovarova. 1996. The immune response against Francisella tularensis live vaccine strain in Lps(n) and Lps(d) mice. FEMS Immunol. Med. Microbiol. 13:235–238. ↑
- Christopher W. Cluff, Jory R. Baldridge, Axel G. Stōver,1 Jay T. Evans, David A. Johnson,Michael J. Lacy, Valerie G. Clawson,2 Vonnie M. Yorgensen,2 Craig L. Johnson,Mark T. Livesay, Robert M. Hershberg, and David H. Persing Synthetic Toll-Like Receptor 4 Agonists Stimulate Innate Resistance to Infectious Challenge INFECTION AND IMMUNITY, May 2005, p. 3044–3052 Vol. 73, No. 5 ↑
- Mihai G. Netea1, Chantal van der Graaf, Jos W. M. Van der Meer and Bart Jan Kullberg Toll-like receptors and the host defense against microbial pathogens: bringing specificity to the innate-immune system Journal of Leukocyte Biology. 2004;75:749-755.↑
- Richard D. Granstein, Wanhong Ding, Jing Huang, Aton Holzer, Richard L. Gallo, Anna Di Nardo, and John A. Wagner Augmentation of Cutaneous Immune Responses by ATP_S: Purinergic Agonists Define a Novel Class of Immunologic Adjuvants The Journal of Immunology, 2005, 174: 7725–7731. ↑
- la Sala, A., D. Ferrari, F. Di Virgilio, M. Idzko, J. Norgauer, and G. Girolomoni. 2003. Alerting and tuning the immune response by extracellular nucleotides. J. Leukocyte Biol. 73: 339–343. ↑
- Di Virgilio, F. 2005. Purinergic mechanism in the immune system: a signal of danger for dendritic cells. Purinergic Signal. 1: 205–209. ↑
- Narcisse, L., E. Scemes, Y. Zhao, S. C. Lee, and C. F. Brosnan. 2005. The cytokine IL-1β transiently enhances P2X7 receptor expression and function in human astrocytes. Glia 49: 245–258 ↑
- L. Rossi, R. Manfredini, F. Bertolini, D. Ferrari, M. Fogli, R. Zini, S. Salati, V. Salvestrini, S. Gulinelli, E. Adinolfi, et al. The extracellular nucleotide UTP is a potent inducer of hematopoietic stem cell migration Blood, January 15, 2007; 109(2): 533 – 542. ↑
- Richard D. Granstein, Wanhong Ding, Jing Huang, Aton Holzer, Richard L. Gallo,Anna Di Nardo, and John A. Wagner Augmentation of Cutaneous Immune Responses by ATP_S: Purinergic Agonists Define a Novel Class of Immunologic Adjuvants The Journal of Immunology, 2005, 174: 7725–7731. ↑
- William A. Pinz Non-vescicular cholesterol transport in cells Prog Lipid Res. 2007 November ; 46(6): 297–314 ↑
- Chikako Kiyohara, Keiko Tanaka and Yoshihiro Miyake Genetic Susceptibility to AtopicDermatitis Allergology International. 2008;57:39-56 ↑
- Eichenfield LF, Hanifin JM, Beck LA, et al. Atopic dermatitis and asthma: parallels in the evolution oftreatment. Pediatrics 2003; 111(3):608-616. ↑
- Byung In Ro_ and Thomas L. Dawson The Role of Sebaceous Gland Activity and Scalp Microfloral Metabolism in the Etiology of Seborrheic Dermatitis and Dandruff J Investig Dermatol Symp Proc 10:194 –197, 2005 ↑
- Howell MD, Wollenberg A, Gallo RL, et al. Cytokine milieu of atopic dermatitis skin subverts the innate immune response to vaccinia virus. Immunity. 2006;24:341-348 ↑
- N. Lacey, S. Delaney, K. Kavanagh and F.C. Powell* Mite-related bacterial antigens stimulate inflammatory cells in rosacea British Journal of Deramtology Volume 157 Issue 3, Pages 474 – 481 June 2007 ↑
- Optimizing skin protection with semipermeable gloves Dermatitis 2004-Dec; vol 15 (issue 4) : pp 184-91 ↑
- Elaine Larson Hygiene of the Skin: When Is Clean Too Clean? Emerging Infectious Diseases Vol. 7, No. 2, March–April 2001 ↑
- ELIZABETH L. CROCKETT Cholesterol Function in Plasma Membranes from Ectotherms:Membrane-Specific Roles in Adaptation to Temperature AMER. ZOOL, 38:291-304 (1998) ↑

Deja una respuesta