¿Como pudo pasar inadvertida la inmunidad innata por tanto tiempo?
Desde 1900, los científicos han intuido que la inmunidad innata tiene mucho que ofrecer por sí misma (autónomamente). Gradualmente ha emergido que la resistencia a retos no necesariamente es tarea exclusiva de células imunitarias, sino que igualmente las células somáticas diferenciadas cumplen ese trabajo, tempranamente, sin demora en la respuesta.
Presentar el control del tejido/microambiente como una forma de intervenir en la respuesta celular autónoma constitutiva, buscando un interactoma óptimo para su inducción, ha sido una tarea ardua. Desafía la farmacología tal como se concibe actualmente y requiere nuevas reformulaciones mecanísticas multivalentes con un léxico novedoso, necesariamente desconocido para la mayoría.
Los descubrimientos sobre la resistencia en la inmunidad innata se han descrito en capítulos separados y nunca se han explicado de forma exhaustiva. «La ventana de respuesta autónoma de la célula para la curación avanzada» constituye un primer intento de recopilar dicho conocimiento y explicar su funcionamiento colectivo, mucho antes de que la respuesta active los componentes inflamatorios tardíos de la resistencia (inmunidad adaptativa). Esta perspectiva se basa en una sólida base científica y una fuerte evidencia clínica, pero en algunos aspectos del mecanismo constitutivo, carece de validación en la investigación celular y molecular. Con un mayor desarrollo, se espera que la elucidación a este nivel sea coherente con el aspecto molecular teórico.
Las principales evidencias que motivaron la redacción del artículo sobre el concepto de inmunidad innata consistieron en el resultado ideal de regeneración y curación observado en investigaciones iniciales y trasladado a la práctica clínica, y la formidable defensa contra las infecciones detectada en los tejidos lesionados, ambas bastante obvias y sin precedentes. La primera evidencia se describe detalladamente en el artículo. Sin embargo, nuevas evidencias sobre la defensa antimicrobiana de la inmunidad innata, que no se incluyen en el artículo, se citan y se comentan brevemente a continuación, lo que refuerza los numerosos hallazgos sobre la capacidad del tejido lesionado para combatir las infecciones y mantenerse libre de ellas.
Durante décadas, se creyó que la función principal de los péptidos derivados de la degradación proteasómica era la presentación de antígenos por el complejo mayor de histocompatibilidad de clase I para activar la inmunidad adaptativa de las células T. Sin embargo, investigaciones de la última década han aclarado que su función se extiende a la generación de péptidos antimicrobianos con propiedades catiónicas en una escala y variedad inimaginables. Esto se logra mediante una degradación proteasómica tríptica adicional, causada por cambios en la composición y función proteómicas, inducida por patógenos, que finalmente induce la extracción de estas fracciones catiónicas. Dichas fracciones perforan la membrana del patógeno, provocando la detención del crecimiento bacteriano; sin participación de la inmunidad adaptativa, y aún dentro de la primera línea de defensa (2).
En 2011, Ponpuak y Deretic (3) describieron que, en la autofagia, los fagosomas son más que simples vacuolas de residencia para *M. tuberculosis*. La molécula adaptadora p62, o sequestosoma 1, interactúa con los sustratos fagosómicos y secuestra componentes citosólicos inocuos (la proteína ribosomal rpS30, el precursor FAU y la ubiquitina) para su degradación, liberando péptidos antimicrobianos a partir del material utilizado o desechado. Esto confiere al fagosoma características lisosomales y de maduración, que, junto con la captura de hidrolasas y la movilización intermedia de sustratos y su acidificación, finalmente conducen a su fusión en un verdadero autolisosoma. Por lo tanto, se cuestiona la suposición de que el resultado de esta transformación fuera simplemente proporcionar aminoácidos libres para su reciclaje durante períodos de inanición. Posteriormente se dilucidó que la proteólisis de estas proteínas citosólicas da como resultado una mezcla de péptidos crípticos con actividad antimicrobiana, que constituyen los nuevos antibióticos naturales denominados «criptidos», generados a partir de material biológico desechado. También se produce mediante la formación de cadenas específicas a partir de proteínas de superficie bacterianas marcadas con ubiquitina, las cuales pueden ser extraídas de la membrana y procesadas por los proteasomas, comprometiendo seriamente la integridad de la pared celular bacteriana y provocando la liberación del contenido patógeno al citosol (5). En resumen, la transformación y el reciclaje potencian una valiosa función posterior, como la eliminación de micobacterias, conocidas por su formidable resistencia a la degradación; véase la figura 1.
Figura 1
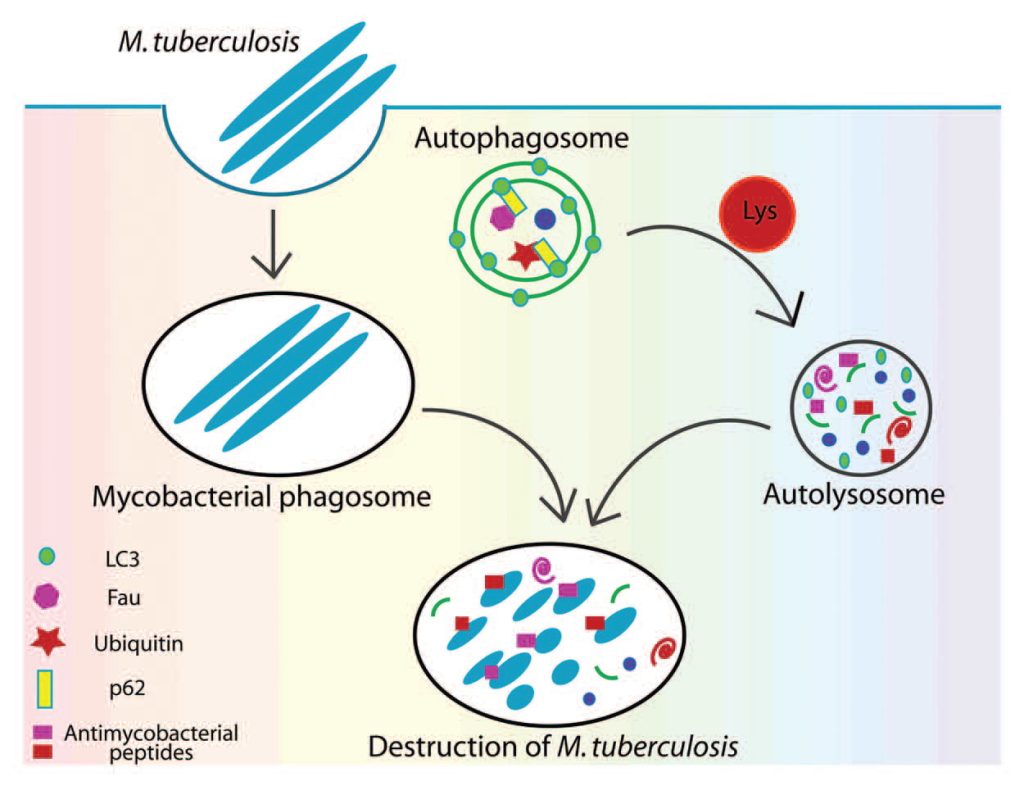
Figura 2
En marzo de 2025, Goldberg et al. (2) aclararon que la producción de criptidos con propiedades catiónicas también ocurre en la función proteasomal, la cual durante décadas se creyó que se limitaba a generar el complejo de histocompatibilidad I o a degradar proteínas inhibidoras (IκB) para activar el factor nuclear kappa B (NF-κB) o precursores proteicos con funciones reguladoras transcripcionales, como Spt23p, Mga2p y Epe1. Sin embargo, también demostraron que la fuente de extracción se encuentra en sustratos extraídos del citosol, como en la autofagia. Además de ser un paso evolutivo fundamental, los péptidos antibacterianos se encuentran en una amplia variedad de tejidos y células y ejercen una actividad de amplio espectro contra bacterias, hongos, virus y algunos parásitos. Además de su acción catiónica, modulan la actividad transcripcional y traduccional en el huésped. Goldberg et al. denominaron a estos péptidos derivados del proteasoma (PDDP-PSEI). Se producen de forma constitutiva, pero su producción también puede inducirse como respuesta a una infección. Una unidad reguladora del proteasoma, PSME3, promueve la degradación tríptica, aumentando los péptidos con extremos catiónicos. Los análisis computacionales de este fenómeno muestran que la mayoría de las proteínas del proteasoma son propensas a esta degradación y, por lo tanto, el potencial del proteasoma para la producción de PDDP es bastante elevado.in silicoLa identificación, mediante el algoritmo Pepsickle (4), de posibles sitios de escisión para obtener aminoácidos de entre 10 y 50 unidades de longitud, clasificados con un rango de eficacia mínima basado en la comparación estructural con péptidos de actividad antibacteriana demostrada, identificó 270 872 péptidos putativos con extremos carboxilo catiónicos. En otras palabras, el 92 % de los genes anotados contienen al menos un péptido con un extremo catiónico. Esto ilustra el enorme potencial de inducir inmunidad celular autónoma para tratar lesiones tisulares, sin riesgo de infección y con una alta probabilidad de generar un antimicrobiano específico para combatir los patógenos implicados en cada caso concreto. Otra función interrelacionada que se añadirá al Continuo de Inmunidad (Fig. 1 del artículo, presentada como póster en esta publicación) introduce el concepto de especificidad inmunitaria temprana y precisa a través de múltiples opciones. En conjunto, se requiere un nuevo enfoque para mejorar la resistencia a la infección y la inmunidad, entendida como un continuo, para finalmente superarla.
La identificación del mecanismo de acción de Cubrisoft (la intervención propuesta en el artículo) dentro de la inmunidad celular autónoma y la ausencia constante de infección en las lesiones tratadas con este producto concuerdan con la investigación descrita por Goldberg et al. La conservación de recursos es fundamental en la resistencia temprana, que se beneficia del desecho de proteínas citosólicas y de un bajo gasto energético, a diferencia de la respuesta dispendiosa de la defensa adaptativa tardía(1). Esta evidencia sitúa a Cubrisoft a la vanguardia en el combate a la infección en tejidos lesionados sin efectos tóxicos ni indeseados, creando las condiciones óptimas para la reparación regenerativa descrita en «La ventana de respuesta autónoma de la célula para la curación avanzada» (1).
Referencias
1. Feoli-Tufi E, Redondo GM, Flores JS, Jara DP. La ventana de respuesta autónoma de la célula para la curación avanzada. Discov Med [Internet]. 10 de octubre de 2025 [citado el 9 de noviembre de 2025];2(1):1-42. Disponible en:https://link.springer.com/article/10.1007/s44337-025-00478-4
2. Goldberg K, Lobov A, Antonello P, Shmueli MD, Yakir I, Weizman T, et al. Inmunidad innata celular autónoma mediada por péptidos de defensa derivados del proteasoma. Nature [Internet]. Marzo de 2025 [consultado el 9 de noviembre de 2025];639(8056):1032-41. Disponible en:https://www.nature.com/articles/s41586-025-08615-w
3. Ponpuak M, Deretic V. Autophagy and p62/sequestosoma 1 generate neo-antimicrobial peptides (cryptides) from cytosolic proteins. Autophagy [Internet]. March 1, 2011 [cited November 9, 2025];7(3):336-7. Available from:https://doi.org/10.4161/auto.7.3.14500
4. Weeder BR, Wood MA, Li E, Nellore A, Thompson RF. Pepsickle predice de forma rápida y precisa los sitios de escisión proteasomal para una mejor identificación de neoantígenos. Bioinformatics [Internet]. Sep 2021;37(21):3723-33. Disponible en:https://doi.org/10.1093/bioinformatics/btab628
5. Ghosh Sourav, Roy Suvapriya, Baid Navin. La AAA-ATPasa del huésped VCP/p97 lisa bacterias intracelulares ubiquitinadas como defensa antimicrobiana innata.Microbiología de la naturaleza2025; 10(5):1099–1114 Disponible en: https://www.nature.com/articles/s41564-025-01984-y?utm_campaign=related_content&utm_source=HEALTH&utm_medium=communities

Deja una respuesta